
【题目】某化学兴趣小组对某铜锌合金样品进行探究实验.称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.求: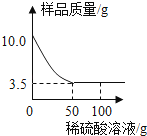
(1)铜锌合金中,Zn的质量分数是
(2)所用稀硫酸溶液中溶质的质量分数是多少?
【答案】
(1)65%
(2)
解:设反应中消耗稀硫酸溶液中溶质的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 98
6.5g x
![]() x=9.8g
x=9.8g
所用稀硫酸溶液中溶质的质量分数为:![]()
![]() 100%=19.6%.
100%=19.6%.
答:所用稀硫酸溶液中溶质的质量分数是19.6%.
【解析】(1)由反应的实验情况图,完全反应后剩余固体的质量为3.5g,即铜锌合金样品中含铜的质量为3.5g,则锌的质量为10g﹣3.5g=6.5g.
铜锌合金中,Zn的质量分数是:![]()
![]() 100%=65%;
100%=65%;
( 2 )设反应中消耗稀硫酸溶液中溶质的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 98
6.5g x![]() x=9.8g
x=9.8g
所用稀硫酸溶液中溶质的质量分数为:![]() 100%=19.6%.
100%=19.6%.
答:所用稀硫酸溶液中溶质的质量分数是19.6%.
根据题意,锌与稀硫酸反应生成硫酸锌和氢气;由反应的实验情况图,完全反应后剩余固体的质量为3.5g,即铜锌合金样品中含铜的质量为 3.5g;则锌的质量为10g﹣3.5g=6.5g;由参加反应的锌的质量,计算出参加反应硫酸的质量,进而可计算出所用稀硫酸溶液中溶质的质量分数.


科目:初中化学 来源: 题型:
【题目】实验室有一瓶标签受到腐蚀(如图所示)的无色溶液,老师叫各小组开展探究.
【提出问题】这瓶无色溶液究竟是什么物质的溶液?
【猜想与假设】经了解得知,这瓶无色溶液原是放在存放盐溶液的柜子里.由此猜测:可能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中某一种的溶液.
【理论分析】为了确定该溶液,他们首先进行了分析:
(1)甲同学根据标签上的组成元素认为一定不可能是溶液.
(2)乙同学提出,碳酸氢钠、硝酸钠的溶液也不可能,他的依据是 .
(3)【设计实验】为了确定该溶液究竟是剩余两种盐的哪一种溶液,他们设计了如下实验.
实 验 操 作 | 实 验 现 象 |
①取少量该无色溶液于试管中,慢慢滴加BaCl2溶液. | 产生白色沉淀. |
【实验结论】该瓶无色溶液的溶质是 . 生成白色沉淀的化学方程式是 .
(4)【实验反思】丙同学认为原设计的实验还可简化,同样达到鉴别的目的.丙同学设计的实验如下(将实验操作及实验现象填入相应的空格中):
实 验 操 作 | 实 验 现 象 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列是实验室制备CO2 , 并验证CO2性质的实验装置图,按要求回答下列问题: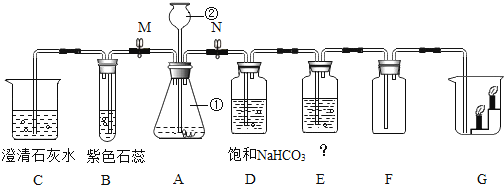
(1)写出标号仪器的名称:① , ② .
(2)在检查装置A的气密性操作时,当关闭活塞M和N,向仪器②中注水,观察到的现象,说明装置漏气.
(3)关闭活塞N,打开活塞M,向仪器②中加入稀盐酸,装置B处观察到的现象是:、 当观察到C处的石灰水变浑浊时,则C中发生的化学反应方程式是
(4)关闭活塞M,打开活塞N.用A、D、E、F制取纯净干燥的CO2气体,装置D的作用是 ,装置E中盛装 溶液,用于除去CO2气体中的水分;当观察到 ,说明F中已收满二氧化碳气体.
(5)若关闭活塞M,打开活塞N.实验室要制取干燥的氧气用A、D、E、F、G中,只需选用的装置是 (填编号),化学反应方程式是: .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于分子的叙述中,正确的是( )
A.一切物质都是由分子构成
B.分子是不能够再分的粒子
C.分子是保持物质化学性质的最小粒子
D.分子是化学变化中的最小粒子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现代循环经济要求综合考虑环境污染和经济效益.高纯氧化铁可作现代电子工业的材料,以下是以硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:[(NH4)2CO3溶液呈碱性,40℃以上时(NH4)2CO3分解]. 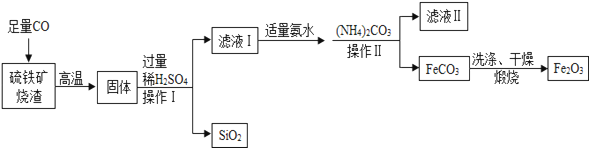
(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器有玻璃棒、烧杯、等.
(2)滤液Ⅰ中主要的阳离子是等.
(3)加适量氨水的目的是 .
(4)根据题中信息,加入(NH)4CO3后,该反应必须控制的条件是 .
(5)滤液Ⅱ中可回收的产品是(写化学式).
(6)写出在空气中煅烧FeCO3的化学反应方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com