
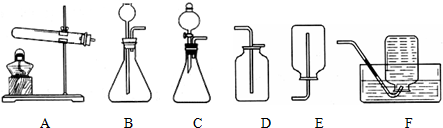
分析 【进行实验】
二氧化碳能使澄清的石灰水变浑浊;
【拓展应用】
乙炔不易溶于水,可以用排水法收集;
解答 解:【进行实验】
取少量白色固体加入到水中,取上层清液,通入二氧化碳气体,有白色沉淀出现,证明猜想三成立.该反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
【拓展应用】
装置C中的分液漏斗能使反应随时发生、随时停止,乙炔的密度比空气略小,不能用排空气法收集,只能够用排水法收集;
故填:C、F;
故答案为:(二)CO2;
化学方程式:Ca(OH)2+CO2=CaCO3↓+H2O
装置是:CF
点评 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:初中化学 来源: 题型:选择题
| 物质 | 杂质 | 除杂质应选用的试剂和操作方法 | |
| A | CO2 | CO | 通入O2,点燃 |
| B | NaOH固体 | Na2CO3固体 | 加入过量盐酸,蒸发 |
| C | Cu(NO3)2溶液 | AgNO3溶液 | 加入过量的铜粉,过滤 |
| D | CuO固体 | Cu固体 | 加入适量的稀硫酸溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
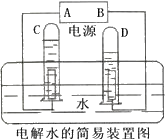 如图是电解水的简易装置.
如图是电解水的简易装置.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫酸铜晶体 明矾 CuSO4 | B. | 氢氧化钠 纯碱 Na2CO3 | ||
| C. | 氯化钠 食盐 NaCl | D. | 碳酸钙 生石灰 Ca(OH)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
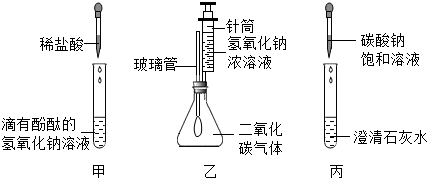
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液钮中上层清液于试管中,加入过量氯化钙溶液,静置. | 猜想l正确 | |
| 没有白色沉淀,溶液呈红色 | 猜想2正确 | |
| 猜想3正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com