
分析 (1)根据碳酸钙在高温的条件下会发生分解进行分析;
(2)根据碳元素的质量分数的计算方法进行分析;
(3)根据酸雨的pH值小于5.6进行分析;
(4)根据尼龙的耐磨性比羊毛强进行分析.
解答 解:(1)碳酸钙在高温的条件下会发生分解,所以热稳定性:氯化钠>碳酸钙;
(2)甲醛和醋酸中的碳、氢、氧原子个数比都是1:2:1,所以含碳量:甲醛(CH2O)=醋酸(C2H4O2);
(3)酸雨的pH值小于5.6,所以酸碱度(pH):酸雨<碳酸饮料;
(4)尼龙的耐磨性比羊毛强,所以耐酸、耐碱性:羊毛<尼龙.
故答案为:(1)>;
(2)=;
(3)<;
(4)<.
点评 本题主要考查了物质物理性质和化学性质的比较,难度不大,需要加强识记即可完成.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:初中化学 来源: 题型:解答题
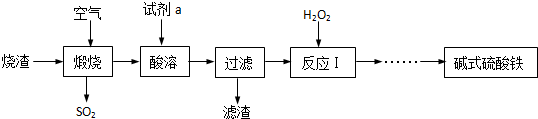
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
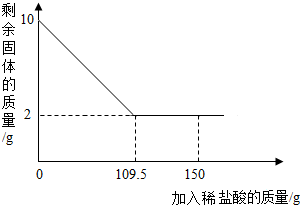 有一赤铁矿样品(主要成分为氧化铁),某学校化学兴趣小组为了测得样品中氧化铁的质量分数,进行了如下探究:小明取10g赤铁矿样品(杂质不溶于水和酸),不断加入稀盐酸到固体的质量不再减少,加入稀盐酸的量如图所示:求:
有一赤铁矿样品(主要成分为氧化铁),某学校化学兴趣小组为了测得样品中氧化铁的质量分数,进行了如下探究:小明取10g赤铁矿样品(杂质不溶于水和酸),不断加入稀盐酸到固体的质量不再减少,加入稀盐酸的量如图所示:求:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | Y>X>Z | C. | Y>Z>X | D. | Z>Y>X |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com