
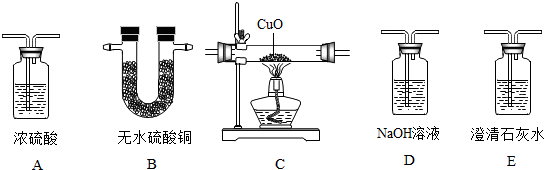
分析 (1)要验证混合气体中各种气体H2,CO,CO2和H2O(气)的存在,首先要验证并除去二氧化碳和水,防止对后面实验的影响,然后根据现象分析.澄清石灰水能够验证和吸收二氧化碳,浓硫酸和无水硫酸铜可以吸收水分,无水硫酸铜遇水变蓝,验证水的存在,灼热的氧化铜可以验证氢气或一氧化碳的存在.
(2)首先可利用质量守恒定律,计算燃烧过程中化合物的质量;然后根据燃烧的规律,由生成的二氧化碳和水分别计算中化合物中C、H元素质量,由C、H元素质量和与化合物质量对比,判断化合物中是否含有O元素,并由各元素的质量确定化合物中各元素的质量比.
解答 解:(1)①要验证混合气体中各种气体H2,CO,CO2和H2O(气)的存在,首先要验证并除去二氧化碳和水,防止对后面实验的影响,所以要先通过无水硫酸铜,再通过澄清石灰水,验证二氧化碳和水,再通过氢氧化钠溶、浓硫酸液除去二氧化碳和水;然后继续通过加热的氧化铜,再通过无水硫酸铜验证是否有水生成,最后通过澄清石灰水,看二氧化碳的生成,所以该学生所选择的仪器装置及合理的先后排列顺序是:B-E-D-A-C-B-E.
②由①题的分析可知:第一个装置:验证原混合气体中是否含有H2O(气);第三个装置:将原混合气体中的CO2除去;
故答案为:(1)①B-E-D-A-C-B-E.②验证原混合气体中是否含有H2O(气);将原混合气体中的CO2除去;
(2)是吸收二氧化碳和水,而不是验证二氧化碳和水,要先通过浓硫酸吸水,然后通过氢氧化钠溶液吸收二氧化碳(检验二氧化碳用石灰水是利用产生沉淀的现象,而吸收二氧化碳利用氢氧化钠溶液,是因为氢氧化钠的溶解度答);
根据质量守恒定律,化合物的质量=4.4g+3.6g-4.8g=3.2g
4.4g二氧化碳中C元素质量=4.4g×$\frac{12}{44}$×100%=1.2g,3.6g水中H元素质量=3.6g×$\frac{2}{18}$×100%=0.4g
则3.2g化合物中含C、H元素的质量=1.2g+0.4g=1.6g,因此化合物中除C、H元素外还含有O元素
化合物中C、H、O元素质量比=1.2g:0.4g:(3.2g-1.2g-0.4g)=3:1:4
故答案为:AD;CHO;3:1:4.
点评 此题难度较大,需要同学们具备较为综合的化学基本知识.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 猜 想 | 验证猜想的实验步骤 | 现象及结论 |
| 我认为此气体可能是氧气 | 把带火星的木条伸入集气瓶中 | 木条复燃,证明该气体是氧气 |
| 产生此气体的一个化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ | ||
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
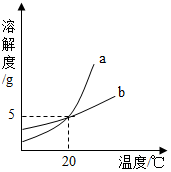 如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )
如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )| A. | a的溶解度大于b的溶解度 | |
| B. | 在20℃时,a、b的溶液中溶质的质量分数相同 | |
| C. | a、b的溶解度都随温度升高而增大 | |
| D. | a、b都属于易溶物质 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2SO4、NaOH、Mg Cl2、CaO | B. | NaOH、H2SO4、Mg Cl2、CaO | ||
| C. | Mg Cl2、H2SO4、NaOH、CaO | D. | CaO、NaOH、H2SO4、Mg Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com