【答案】
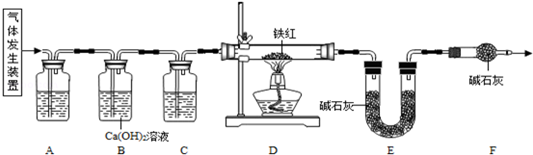
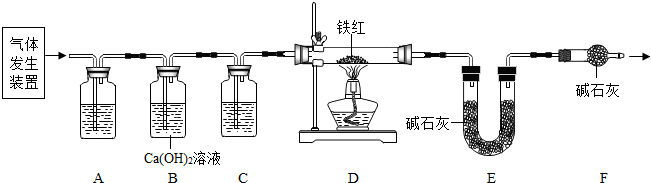
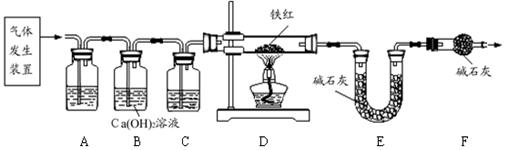
分析:草酸晶体(H
2C
2O
4?3H
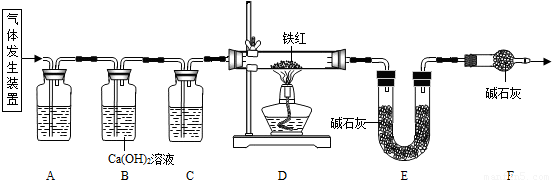
2O)在浓硫酸作用下受热分解,因此选用d装置;实验前应先检查装置的气密性,二氧化碳一般用氢氧化钠溶液吸收,用澄清的石灰水检验,还可以检验二氧化碳是否除尽,二氧化碳可以用浓硫酸干燥;加热之前通入一氧化碳的目的是:将装置中的空气排出,防止发生爆炸;加热之后通入一氧化碳的目的是:驱赶装置中滞留的二氧化碳,使其全部被E装置中碱石灰全部吸收.一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,配平即可;如果全部是氧化铁,铁的最少量是10g×70%=7.0g,如果全部是氧化亚铁,铁的最大量是10g×77.8%=7.78g;E装置增重6.6g,那么二氧化碳是6.6g,氧元素的质量=6.6g×
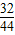
=4.8g,因为4.8g氧元素的质量一半来自于一氧化碳,一半来自于铁的氧化物,那么铁红中氧元素的质量是4.8g÷2=2.4g,则铁红中铁的质量分数=
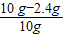
×100%=76.0%;本实验中如果缺少C装置,水蒸气会通过,E装置也具有吸水性,因此E装置会增重,氧元素的质量偏大,则测得样品中铁的质量分数会偏小;实验装置的一个明显缺陷:缺少尾气处理装置或检验水是否除尽.
解答:解:(1)草酸晶体(H
2C
2O
4?3H
2O)在浓硫酸作用下受热分解,因此选用d装置,故答案为:d
(2)实验前应先检查装置的气密性,故答案为:检查装置的气密性
(3)二氧化碳一般用氢氧化钠溶液吸收,用澄清的石灰水检验,还可以检验二氧化碳是否除尽,一氧化碳可以用浓硫酸干燥;故答案为:c;a
(4)B装置还可以检验二氧化碳是否除尽,故答案为:验证二氧化碳已除尽
(5)加热之前通入一氧化碳的目的是:将装置中的空气排出,防止发生爆炸;加热之后通入一氧化碳的目的是:驱赶装置中滞留的二氧化碳,使其全部被E装置中碱石灰全部吸收.故答案为:①将装置中的空气排出,防止发生爆炸;②驱赶装置中滞留的二氧化碳,使其全部被E装置中碱石灰全部吸收.(合理即可)
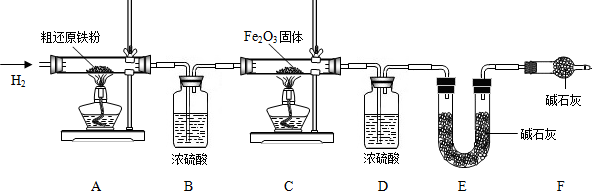
(6)一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,配平即可;故答案为:3CO+Fe
2O
3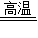
2Fe+3CO
2,(一氧化碳与FeO、Fe
3O
4也可以)
(7)如果全部是氧化铁,铁的最少量是10g×70%=7.0g,如果全部是氧化亚铁,铁的最大量是10g×77.8%=7.78g;E装置增重6.6g,那么二氧化碳是6.6g,氧元素的质量=6.6g×
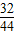
=4.8g,因为4.8g氧元素的质量一半来自于一氧化碳,一半来自于铁的氧化物,那么铁红中氧元素的质量是4.8g÷2=2.4g,则铁红中铁的质量分数=
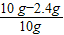
×100%=76.0%;故答案为:①7.0;7.78;②76.0%
实验反思:本实验中如果缺少C装置,水蒸气会通过,E装置也具有吸水性,因此E装置会增重,氧元素的质量偏大,则测得样品中铁的质量分数会偏小;实验装置的一个明显缺陷:缺少尾气处理装置.故答案为:偏小;缺少尾气处理装置.
点评:本考点属于实验探究题,实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验现象和分析,得到了正确的结论,属于实验过程和结论的探究.同学们要具体分析,综合掌握.本题型主要出现在实验题中.

 CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O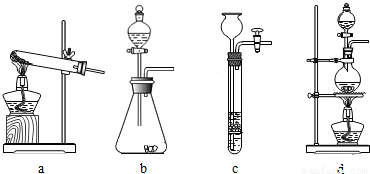
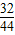 =4.8g,因为4.8g氧元素的质量一半来自于一氧化碳,一半来自于铁的氧化物,那么铁红中氧元素的质量是4.8g÷2=2.4g,则铁红中铁的质量分数=
=4.8g,因为4.8g氧元素的质量一半来自于一氧化碳,一半来自于铁的氧化物,那么铁红中氧元素的质量是4.8g÷2=2.4g,则铁红中铁的质量分数=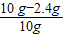 ×100%=76.0%;本实验中如果缺少C装置,水蒸气会通过,E装置也具有吸水性,因此E装置会增重,氧元素的质量偏大,则测得样品中铁的质量分数会偏小;实验装置的一个明显缺陷:缺少尾气处理装置或检验水是否除尽.
×100%=76.0%;本实验中如果缺少C装置,水蒸气会通过,E装置也具有吸水性,因此E装置会增重,氧元素的质量偏大,则测得样品中铁的质量分数会偏小;实验装置的一个明显缺陷:缺少尾气处理装置或检验水是否除尽. 2Fe+3CO2,(一氧化碳与FeO、Fe3O4也可以)
2Fe+3CO2,(一氧化碳与FeO、Fe3O4也可以)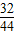 =4.8g,因为4.8g氧元素的质量一半来自于一氧化碳,一半来自于铁的氧化物,那么铁红中氧元素的质量是4.8g÷2=2.4g,则铁红中铁的质量分数=
=4.8g,因为4.8g氧元素的质量一半来自于一氧化碳,一半来自于铁的氧化物,那么铁红中氧元素的质量是4.8g÷2=2.4g,则铁红中铁的质量分数=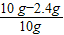 ×100%=76.0%;故答案为:①7.0;7.78;②76.0%
×100%=76.0%;故答案为:①7.0;7.78;②76.0%

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案