将干燥、纯净的氯酸钾与二氧化锰混合,取15g混合物装入试管中加热,待充分反应后,将剩余固体物质冷却后称得其质量为10.2g,试回答:
(1)根据________定律,反应后可生成氧气________g.
(2)10.2g剩余固体中含有________和________两种物质.
(3)求原混合物中二氧化锰的质量.
解:(1)根据质量守恒定律,反应后可生成氧气的质量=15g-10.2g=4.8g;
(2)因为在此反应中,二氧化锰是催化剂,催化剂不参与反应,反应前后质量不变;氯酸钾分解的化学方程式为:2KClO
3
2KCl+3O
2↑,故充分反应后,剩余固体中含有生成的KCl和催化剂MnO
2;
(3)设反应生成的KCl的质量为x,
2KClO
3
2KCl+3O
2↑
149 96
x 4.8g
∴
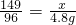
,
∴x=

=7.45g;
则原混合物中二氧化锰的质量为:10.2g-7.45g=2.75g.
答:原混合物中二氧化锰的质量为2.75g.
分析:(1)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.故反应后可生成氧气的质量=反应前物质质量总和-反应后物质质量总和;
(2)根据氯酸钾反应的化学方程式和催化剂的性质分析剩余固体中含有的物质;
(3)因为二氧化锰是催化剂,催化剂不参与反应,反应前后质量不变.所以利用氯酸钾分解的化学方程式和生成氧气的质量,列出比例式,就可计算出反应生成的KCl的质量,那么,反应后剩余固体的质量减去反应生成的KCl的质量就是原混合物中二氧化锰的质量.
点评:本题主要考查学生利用化学方程式进行计算的能力.解题的关键是要知道二氧化锰在此反应中是催化剂,反应前后质量不变.

 2KCl+3O2↑,故充分反应后,剩余固体中含有生成的KCl和催化剂MnO2;
2KCl+3O2↑,故充分反应后,剩余固体中含有生成的KCl和催化剂MnO2; 2KCl+3O2↑
2KCl+3O2↑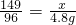 ,
, =7.45g;
=7.45g;

 阅读快车系列答案
阅读快车系列答案