

分析 探究一:氧气能使带火星的木条复燃;
根据物质的性质可以判断保存方法;
探究二:为保证测量结果的准确性,收集气体的时机是导管口还没有气泡产生时,因为这样不会导致生成的气体损失,全面进入量筒中;
根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
滴加的Na2CO3溶液要过量的原因是使氯化钙完全反应;
氯化钠能和硝酸银反应生成白色沉淀氯化银和硝酸钠;
根据提供的数据和反应的化学方程式可以进行相关方面的计算.
解答 解:探究一:(1)取一定量该供氧剂放置于试管中,向其中加水,再将带火星的木条伸入试管口中,观察到带火星的木条复燃,证明该供氧剂的主要成分为过氧化钙.
故填:带火星的木条复燃.
(2)此供氧剂能和水反应,因此保存方法是密封、干燥保存.
故填:密封、干燥保存.
(3)因为盐酸中的水与CaO2反应会生成O2,即使没有CaCO3与盐酸反应生成CO2,也会有气泡生成,因此不能通过观察到有气泡生成来判断此供氧剂已变质.
故填:不认同,因为盐酸中的水与CaO2反应会生成O2,即使没有CaCO3与盐酸反应生成CO2,也会有气泡生成.
探究二:方案一:(1)取一定质量的供氧剂溶于水,按照图一装置进行装配.充分反应后,待量筒中液面不再变化,还要使量筒内外液面相平,再读出体积.
故填:使量筒内外液面相平.
(2)为保证测量结果的准确性,收集气体的时机是导管口还没有气泡产生时.
故填:a.
(3)用此装置测得的含量会偏大,是因为分液漏斗中滴下的水会占据一部分体积,导致测定的氧气体积偏大,从而导致测定的结构偏大;如果将发生装置换成图二中的装置BCD装置可以避免此误差.
故填:BCD.
方案二:(1)供氧剂与水反应的化学方程式为:2CaO2+2H2O=2Ca(OH)2+O2↑.
故填:2CaO2+2H2O=2Ca(OH)2+O2↑.
(2)滴加的Na2CO3溶液要过量的原因是使氯化钙完全转化为沉淀.
故填:使氯化钙完全转化为沉淀.
(3)洗涤沉淀的目的是除去沉淀表面的可溶性杂质,测量结果更准确.
故填:除去沉淀表面的可溶性杂质,测量结果更准确.
(4)检验沉淀已经洗涤干净的方法是:取最后一次洗涤液,滴加硝酸银溶液,若无明显现象,则表示已经洗净.
故填:硝酸银.
(5)设过氧化钙质量为x,
由2CaO2+2H2O=2Ca(OH)2+O2↑,Ca(OH)2+CO2═CaCO3↓+H2O可知,CaO2~CaCO3,
CaO2~CaCO3,
72 100
x 5g
$\frac{72}{x}$=$\frac{100}{5g}$,
x=3.6g,
供氧剂中的过氧化钙的含量为:$\frac{3.6g}{5g}$×100%=72.0%,
故填:72.0%.
(6)若CaCO3沉淀过滤后不洗涤,则会导致碳酸钙质量偏大,从而导致计算的过氧化钙质量偏大,进一步导致过氧化钙的含量将偏大.
故填:偏大.
(7)此方案排除所加试剂和操作的原因,测定的过氧化钙含量也可能偏大,原因是所测样品中Ca元素还可能还来源于变质生成的Ca(OH)2、CaCO3,从而导致所测过氧化钙含量偏大.
故填:所测样品中Ca元素还可能还来源于变质生成的Ca(OH)2、CaCO3,从而导致所测过氧化钙含量偏大.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:解答题
 如图所示是某药厂生产的葡萄糖注射液的标签.其溶质葡萄糖的化学式是C6H12O6,试计算:
如图所示是某药厂生产的葡萄糖注射液的标签.其溶质葡萄糖的化学式是C6H12O6,试计算:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
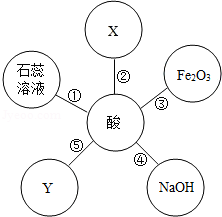 有不同之点.如图体现了酸类物质的化学性质,其中X、Y及图中所给其他物质的类别不同.结合此图回答下列问题.
有不同之点.如图体现了酸类物质的化学性质,其中X、Y及图中所给其他物质的类别不同.结合此图回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一定是烧碱溶液 | B. | 一定是酸溶液 | C. | 可能是中性溶液 | D. | 一定是盐溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  两份完全相同的过氧化氢在有无催化剂情况下制氧气 | |
| B. | 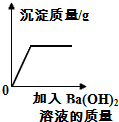 往稀盐酸和CuSO4的混合溶液中加入Ba(OH)2溶液 | |
| C. | 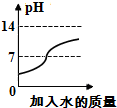 往稀盐酸中加水 | |
| D. | 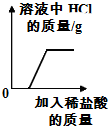 往碳酸钠溶液中加入稀盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 4.8% | B. | 10.7% | C. | 85.6% | D. | 10.2% |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com