
分析 (1)根据已知条件,反应前天平平衡,若反应后天平平衡,说明生成气体的质量相等,而后依据同质量的镁、铝生成氢气的多少分析解答即可;
(2)如果天平不平衡则一定是生成的氢气质量不等,生成氢气量较大的一边质量会小一些,据此分析解答.
解答 解:(1)根据已知条件,反应前天平平衡,若反应后天平平衡,说明生成气体的质量相等,而同质量的金属与酸反应生成的氢气量与$\frac{金属的化合价}{金属的相对原子质量}$成正比,所以同质量的镁比锌与酸反应生成的氢气多一些,故只能是镁有剩余,锌可能有剩余,而酸不会剩余的情况,才能使天平再次平衡;
(2)由以上的分析可知若天平失去平衡,说明生成氢气量不同,因为等质量的锌和镁与足量酸反应时,镁产生的氢气比锌产生的氢气多,天平失去平衡一定是放入镁的一边生成的氢气较多,则天平指针向左偏转;
故答案为:(1)镁;(2)左.
点评 解决天平平衡的有关化学计算,方法是:若反应之前两边质量相同,则在两边分别加入不同物质后,必须是两边的质量变化相等,天平才会平衡.


科目:初中化学 来源: 题型:多选题
| A. | 滤渣中一定没有Fe | |
| B. | 滤渣中一定有Ag,可能有Cu | |
| C. | 滤液中一定含有Fe(NO3)2,一定没有有AgNO3 | |
| D. | 滤液一定有Fe(NO3)2和Cu(NO3)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
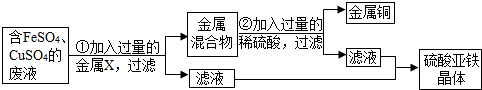
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 修车工人用汽油清洗衣服上的油污 | B. | 用稀盐酸除去铜粉中的铁粉 | ||
| C. | 用洗涤剂洗去抽油烟机上的油污 | D. | 用水冲洗掉试管内的固体粉末 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 | 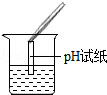 | 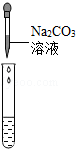 | 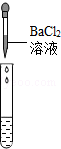 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 次数 | 实验前 | 第1次 | 第2次 |
| 加入稀硫酸的质量/g | 0 | 50 | 50 |
| 剩余固体的质量/g | 5 | 3 | 2 |
| A. | 第1次加入稀盐酸后剩余固体中还有锌 | |
| B. | 第2次所加入的稀硫酸未反应完 | |
| C. | 每50g稀硫酸和1g锌恰好完全反应 | |
| D. | 该黄铜样品中铜的质量分数为40% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com