
| A. | 中子数为14 | B. | 质子数为6 | ||
| C. | 电子数为6 | D. | 质子数和中子数值之和为14 |
分析 在原子中,核内质子数=核外电子数=核电荷数,相对原子质量=质子数+中子数;利用碳-14原子的核电荷数为6,质子数和中子数之和为14来解答.
解答 解:A、由质子数和中子数之和为14,质子数为6,则中子数为14-6=8,说法错误.
B、由碳-14原子的核电荷数为6,根据质子数等于核电荷数,则质子数为6,说法正确.
C、因质子数等于电子数,质子数为6,则电子数为6,说法正确.
D、因核电荷数为6,根据质子数等于核电荷数,则质子数为6,质子数和中子数之和为14,说法正确.
故选A.
点评 本题以新信息为载体来考查学生对教材知识的掌握,学生应学会对新信息的选择使用;同时应熟记在原子中,核内质子数=核外电子数=核电荷数,相对原子质量=质子数+中子数.


科目:初中化学 来源: 题型:解答题
| 海水密度 | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |

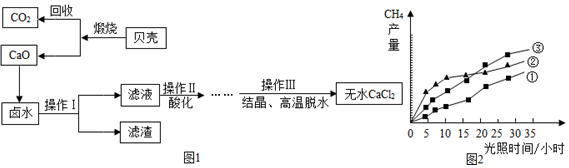
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 实验室用一定质量的氯酸钾和二氧化锰制取氧气,回答下列问题.
实验室用一定质量的氯酸钾和二氧化锰制取氧气,回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
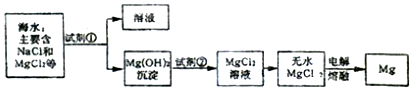
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
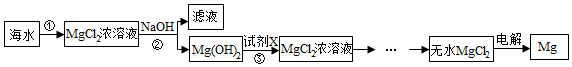
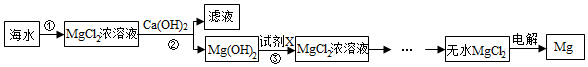
| 试剂 | NaOH | Ca(OH)2 |
| 价格(元/t) | 3200 | 1200 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 复分解反应与中和反应属于包含关系 | |
| B. | 含氧的化合物与盐属于交叉关系 | |
| C. | 化合物与氧化物属于交叉关系 | |
| D. | 纯净物与单质属于包含关系 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 白色粉末中可能含有氯化钠 | |
| B. | 无色溶液B中可能含有两种溶质 | |
| C. | 白色粉末中不含碳酸钙、硫酸钠、硫酸铜 | |
| D. | 步骤③生成的气体质量可能是2.2g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫在氧气中燃烧产生淡蓝色火焰 | |
| B. | 电解水时,正、负电极上产生气体的体积比2:1 | |
| C. | 打开一瓶浓盐酸,瓶口会出现白色烟雾 | |
| D. | 镁在空气中燃烧发出耀眼白光 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com