

分析 (1)根据黄铁矿的主要成分是二硫化亚铁,二硫化亚铁中的铁是亚铁进行分析;
(2)根据质量守恒定律进行分析;
(3)根据酸性气体可以用碱性液体来吸收进行分析;
(4)根据A瓶的作用是除去空气中的二氧化碳进行分析;
(5)根据二氧化硫和氢氧化钠反应会生成亚硫酸钠和水进行分析;
(6)根据C、D中增加的质量是反应生成的二氧化硫,然后结合样品的质量即可求出硫元素的质量分数进行分析;
(7)根据二氧化硫中硫元素的质量分数可以计算生成的二氧化硫中硫的质量,再计算黄铁矿中硫元素的质量分数;
(8)根据过氧化氢有强氧化性,会将亚硫酸钠氧化成硫酸钠,硫酸钠和氯化钡会生成硫酸钡沉淀,再根据硫原子守恒计算硫铁矿中硫的质量,从而计算其质量分数.
解答 解:(1)黄铁矿的主要成分是二硫化亚铁,所以黄铁矿是混合物,FeS2名称为二硫化亚铁中铁元素是亚铁,所以铁元素的化合价是+2价;
(2)通过质量守恒定律可知,在化学反应前后,原子的数目不变,所以经过配平后的方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
(3)尾气中含有HCl等气体,可用碱性液体吸收,如NaOH;
(4)通过分析可知,A瓶的作用是除去空气中的二氧化碳,可以是氢氧化钠溶液,A、B不能颠倒,否则不能将二氧化碳和水蒸气除去,对后面的实验结果造成影响;
(5)二氧化硫和氢氧化钠反应会生成亚硫酸钠和水,化学方程式为:SO2+2NaOH=Na2SO3+H2O;
(6)通过分析可知,C、D中增加的质量是反应生成的二氧化硫,知道了二氧化硫的质量,再结合样品的质量即可求出硫元素的质量分数,所以应称量的数据是:②④;
(7)二氧化硫中硫元素的质量分数为:50%,所以根据(6)中所选数据,甲组同学测得的该黄铁矿中硫元素的质量分数的表达式为:$\frac{{m}_{5}-{m}_{3}}{2{m}_{1}}$;
(8)过氧化氢有强氧化性,会将亚硫酸钠氧化成硫酸钠,硫酸钠和氯化钡会生成硫酸钡沉淀,所以乙组同学最终得到的固体的化学式为:BaSO4,检验所加BaCl2溶液是否过量的方法是:静置,在上层清液再加氯化钡溶液,若无沉淀产生,则已过量,乙组的实验过程中洗涤滤渣的目的是:除去沉淀表面的可溶性杂质,若未洗涤就直接烘干称量,则会使测定结果偏大,检验滤渣是否洗净所用试剂可以是硝酸银或碳酸钠、硫酸钠溶液,硫原子守恒计算硫铁矿中硫的质量,其中BaSO4,的质量为m6g,所以该小组测定的硫元素的质量分数的表达式为:$\frac{32{m}_{6}}{233{m}_{1}}$.
故答案为:(1)混合,+2;
(2)4 11 2 8;
(3)NaOH;
(4)NaOH,吸收空气中的CO2,否;
(5)SO2+2NaOH=Na2SO3+H2O;
(6)②④;
(7)$\frac{{m}_{5}-{m}_{3}}{2{m}_{1}}$;
(8)BaSO4;静置,在上层清液再加BaCl2溶液,若无沉淀产生,则已过量;除去沉淀表面的可溶性杂质;偏大;硝酸银或碳酸钠、硫酸钠;$\frac{32{m}_{6}}{233{m}_{1}}$.
点评 本题考查物质成分和含量的测定,涉及仪器选用、误差分析、质量分数计算等知识,具有较强的综合性,解题时注意从质量守恒的角度分析,本题难度中等.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:初中化学 来源: 题型:填空题
 如图进行试验,请按要求填空.
如图进行试验,请按要求填空.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 无土栽培是利用营养液栽培作物的一种方法.
无土栽培是利用营养液栽培作物的一种方法.
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | “碳纳米泡沫”和金刚石的性质相同 | |
| B. | “碳纳米泡沫”在氧气中充分燃烧的产物只有二氧化碳 | |
| C. | “碳纳米泡沫”是碳单质 | |
| D. | “碳纳米泡沫”是一种新型的碳化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 | 操作 | 主要现象 | 结论与解释 |
| 实验1:初步判断 | 打开这种保鲜剂的包装袋,取少量样品于试管中,观察. | 该样品为黑色固体 | Ⅰ、该保鲜剂一定不是②⑤;(填保鲜剂序号) |
| 实验2:探究保鲜剂有效性 | 向实验1的试管中加入过量的稀盐酸,振荡. | 有气泡产生,溶液逐渐变成浅绿色 | Ⅱ、该保鲜剂④(填“有效”或“无效”); |
| 实验3:探究保鲜剂成分 | 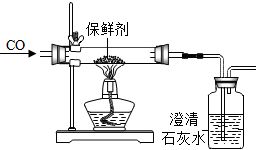 | 澄清石灰水变浑浊 | Ⅲ、综合实验2,该保鲜剂中一定含有的物质是Fe和Fe2O3; |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com