解:(1)海水中含量最多的化学物质是水,其次是氯化钠;
从海水中提取盐最常用的方法是蒸发;
故答案为:氯化钠; 蒸发
(2)粗盐溶于水经过滤后得到的溶液中含有MgSO
4、CaCl
2、NaCl,先向混合溶液中加入足量的NaOH溶液,此时得到的混合物为:
Mg(OH)
2沉淀、Na
2SO
4、Ca(OH)
2沉淀、NaOH、NaCl,再向刚得到的混合中加入过量的BaCl
2溶液,此时得到的混合物为:Mg(OH)
2沉淀、BaSO
4沉淀、Ca(OH)
2沉淀、NaOH、NaCl、BaCl
2,再向混合物中加入过量的Na
2CO
3溶液,得到的混合物为:Mg(OH)
2沉淀、BaSO
4沉淀、CaCO
3沉淀、NaOH、BaCO
3沉淀、NaCl、Na
2CO
3,此混合物经过滤后得到NaOH、NaCl的混合溶液,此时加入适量的盐酸,即可得到较纯净的氯化钠溶液,最后提取氯化钠即可.
故答案为:②⑤④①③
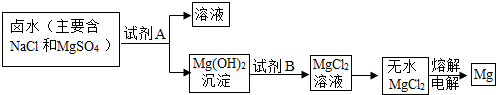
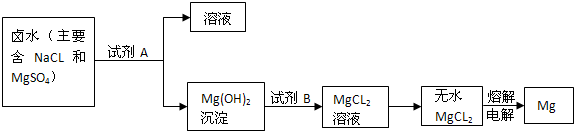
(3)因为该市有丰富的石灰石资源,锻烧石灰石可以得到氧化钙,而氧化钙溶于水可制得氢氧化钙溶液,所以A试剂应是氢氧化钙溶液,该实验流程如下:向NaCl、MgSO
4的混合溶液中加入试剂A即Ca(OH)
2后可得到Mg(OH)
2沉淀,向Mg(OH)
2沉淀中加入B,即稀盐酸可得到MgCl
2溶液,然后经蒸发、电解可得到Mg.电解无水MgCl
2的过程中电能转变为化学能.
故答案为:熟石灰、稀盐酸、电能、化学能;
(4)①反应物是氯化钠溶液、氨气、二氧化碳,生成物中析出碳酸氢钠晶体,然后根据质量守恒定律写出化学反应式配平即可.
故答案为:NaCl+NH
3+H
2O+CO
2=NaHCO
3+NH
4Cl;
②根据加热碳酸氢钠晶体可制得纯碱,可知反应物是碳酸氢钠,反应条件是加热,生成物中有纯碱,然后根据质量守恒定律写出化学反应式.
故答案为:2NaHCO
3
Na
2CO
3+CO
2↑+H
2O.
分析:(1)根据海水的成分及获得粗盐的方法即可作答;
(2)根据混合溶液的提纯方法分析;
(3)根据石灰石的成分及实验流程分析.
(4)根据反应物、生成物、反应条件和质量守恒定律写出化学反应式.
点评:分离混合物时所加试剂要考虑是否需要过量,且最后还需要考虑过量试剂是否需要除去.

 Na2CO3+CO2↑+H2O.
Na2CO3+CO2↑+H2O.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案