
 期末集结号系列答案
期末集结号系列答案科目:初中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 温度 (℃) | 溶解度 (g/100g水) |
| 20 | 36.0 |
| 40 | 36.6 |
| 60 | 37.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 玻璃容器都可用作反应容器 | |
| B. | 蜡烛火焰与酒精灯火焰都分为外焰、内焰和焰心 | |
| C. | 给试管里的固体或液体加热时,试管口不可对着人 | |
| D. | 用量筒量取液体和用托盘天平称量固体时,读数都只能有一位小数 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
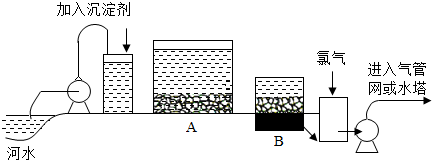
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 金属 | 稀盐酸 | 反应方程式 |
| Mg | HCl | Mg+2HCl═MgCl2+H2↑ |
| Fe | HCl | Fe+2HCl=FeCl2+H2↑ |
| Zn | HCl | |
| … | … | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com