
【题目】2018年10月23日,举世瞩目的港珠澳大桥正式开通,其总用钢量接近100万吨!请根据所学金属的有关知识回答:
(1)以赤铁矿为例,写出工业炼铁的反应原理____ (用化学方程式表示)。
(2)向m克AgNO3、Cu(NO3)2和Fe(NO3)2的混合溶液中加入Zn,充分反应后过滤,所得滤液质量仍为m克,则滤渣中一定有什么物质____?并写出可能发生的反应的化学方程式____。
【答案】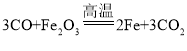 Ag、Cu
Ag、Cu ![]()
【解析】
(1)用赤铁矿为原料进行炼铁,反应原理是氧化铁和一氧化碳高温生成二氧碳和铁,化学方程式为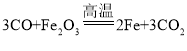 。
。
(2)向m克AgNO3、Cu(NO3)2和Fe(NO3)2的混合溶液中加入Zn,根据金属活动性顺序,锌能依次置换银、铜和铁,而充分反应后过滤,所得滤液质量仍为m克,根据质量守恒定律,反应前后溶液质量相等,则参加反应锌的质量一定等于生成金属固体的质量。锌先与硝酸银反应,方程式为![]() ,依据化学方程式,参加反应锌的质量与生成银的质量比为65:216,由此可知,生成金属银的质量大于参加反应锌的质量,所以锌还一定与硝酸铜反应,反应方程式为
,依据化学方程式,参加反应锌的质量与生成银的质量比为65:216,由此可知,生成金属银的质量大于参加反应锌的质量,所以锌还一定与硝酸铜反应,反应方程式为![]() ,依据化学方程式,参加反应的锌的质量与生成铜的质量比为65:64,由此可知,生成金属铜的质量小于参加反应锌的质量。如果参加反应锌的质量一定等于生成金属固体的质量。
,依据化学方程式,参加反应的锌的质量与生成铜的质量比为65:64,由此可知,生成金属铜的质量小于参加反应锌的质量。如果参加反应锌的质量一定等于生成金属固体的质量。
则滤渣中一定有银和铜;可能还有铁,所以可能发生反应的化学方程式为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】下列图象能正确反映对应实验操作的是( )
A.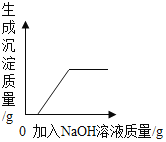 向氯化钾和硫酸铜的混合溶液中滴加氢氧化钠溶液
向氯化钾和硫酸铜的混合溶液中滴加氢氧化钠溶液
B.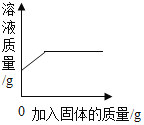 在一定量的稀盐酸中加入过量石灰石
在一定量的稀盐酸中加入过量石灰石
C.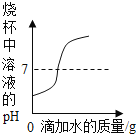 向盛有一定量稀硫酸的烧杯中不断加水稀释
向盛有一定量稀硫酸的烧杯中不断加水稀释
D.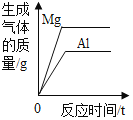 将等质量的镁粉和铝粉分别与足量等浓度的稀硫酸反应
将等质量的镁粉和铝粉分别与足量等浓度的稀硫酸反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质(不含结晶水)的溶解度曲线如图,下列叙述正确的是()

A.t2℃时,甲的溶解度为50
B.乙中含有少量甲,可用蒸发溶剂的方法提纯甲
C.t2℃时,将甲、乙饱和溶液降温到t1℃, 所得溶液中溶质质量分数相等
D.t1℃时,等质量的甲、乙饱和溶液,升温到t2℃ ,分别加入20g 的甲、乙,一定可以得到甲、乙的饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属钛(Ti)因具有许多神奇的性能而越来越引起人们的关注,被誉为“未来金属“。常温下钛不和非金属、强酸反应,加热至红热时,能与常见的非金属反应。工业上由钛铁矿(主要成分为FeTiO3)制取金属钛的主要工艺过程如图:
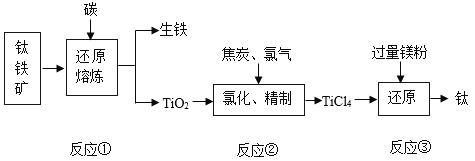
(1)反应前将钛酸亚铁和焦炭磨成粉末状的原因是_____。
(2)TiO2与C、Cl2在高温下反应,生成TiCl4和一种有毒气体,该气体是一种氧化物,其化学式为_____。
(3)写出步骤③中(Ar起保护气作用)在高温时生成金属钛的化学反应方程式_____,该反应的基本类型为_____。
(4)今年来,工业上用电解熔融的TiO2来制取金属钛获得成功,从能量的角度分析,工业利用该方法制备金属Ti的缺点是_____。
(5)如何从反应③后的固体中获得金属钛:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧化锌软膏可用于急性或亚急性皮炎、湿疹、痱子及轻度、小面积的皮肤溃疡。闪锌矿(主要成分为ZnS)是含锌的主要矿物质之一,高温煅烧闪锌矿生成氧化锌和SO2,以氧化锌产品为原料制备纯氧化锌的生产工艺流程如图:
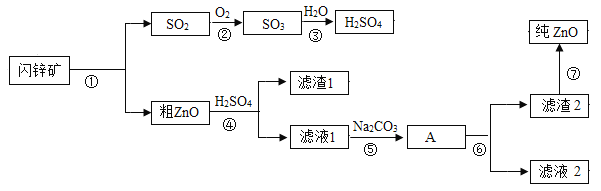
(1)已知滤液2主要成分是硫酸钠,则滤渣2的化学式为___________。
(2)上述步骤中,步骤⑥的操作是_________(填操作名称)。此操作中用到的玻璃仪器有烧杯,玻璃棒、_____________。
(3)步骤④的反应,基本类型是___________反应。
(4)步骤②③两步反应,可以写成一个总的化学反应的化学方程式,该总反应的化学方程式是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】Na2CO3在工业和生活中有重要的作用。它的来源主要有以下两种途径:
I.将制碱与制氨结合起来的联合制碱法。这个方法是由我国的制碱工业先驱_发明的。
A 张青莲
B 道尔顿
C 侯德榜
D 华罗庚
Ⅱ.自然界有很多咸水湖,人们通过“冬天捞喊,夏天晒盐”的方式获得湖盐,其中就含有Na2CO3。
(1)小明同学想对某夏天制得的湖盐样品成分进行探究,查阅资料后他对样品成分做出了三种猜想。
猜想一:NaCl、Na2CO3
猜想二:NaCl、Na2SO4;
猜想三:NaCl、Na2CO3、Na2SO4请帮助他完成如下实验:
实验操作 | 实验现象 | 实验结论 | |
实验一 | 取少量样品于试管中,加适量水溶解后,加入过量稀HNO3 | 产生能使澄清石灰水变浑浊的气体 | 猜想___不成立 |
实验二 | 向实验一所得的溶液中加入适量的________ | __ | 猜想三成立 |
(2)小明同学为进一步确定上述湖盐样品中Na2CO3 的质量分数,取该湖盐样品10.0g做了如图所示的补充实验。(注:所用药品均足量)
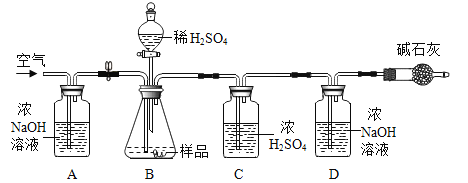
①反应结束之后打开止水夹并通入空气的目的是____。
②装置D中发生的反应为____(用化学方程式表示)。
③实验中碱石灰(含氧化钙和氢氧化钠)的作用是___。
④实验结束后,测得装置D增重0.33g,则该湖盐样品中Na2CO3的质量分数为多少___?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布:请回答下列问题:
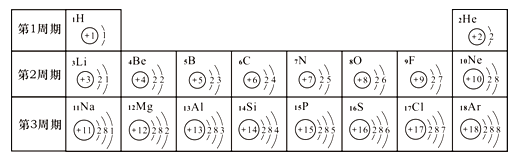
①第17号元素属于_____元素(填“金属”或“非金属”),其次外层电子数为 ______。
②元素的化学性质与原子结构中的 ______________数关系密切;在同一族中,各元素的原子结构呈现的规律有 _______________(任写一点)。
③地壳中含量最多的金属元素与含量最多的非金属元素组成的化合物为 _______。第16号元素在化学反应中容易形成 _________(填离子符号),该元素的单质在氧气中燃烧的现象是__________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质的溶解度曲线如图所示,据图判断下列说法不正确的是( )
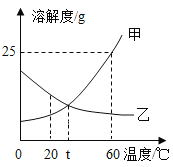
A.20℃时,甲物质的溶解度小于乙物质的溶解度
B.甲物质的溶解度随温度的升高而增大
C.t℃时,甲和乙的饱和溶液的溶质质量分数相等
D.将60 ℃时的甲、乙的饱和溶液降温至t ℃,甲、乙的溶液中均有晶体析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为实验室制取氢气的发生装置.若液面刚好不与锌粒接触而又无酸液可加,要得到氢气, 可从长颈漏斗中加入的适量试剂是( )
①食盐水;②硫酸钠溶液;③氯化钡溶液;④碳酸钠溶液
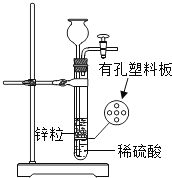
A.①②③B.①②④C.②③④D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com