
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液于试管中 滴加足量的硝酸钙溶液,再滴入几滴酚酞试液 滴加足量的硝酸钙溶液,再滴入几滴酚酞试液 |
出现白色沉淀,酚酞试液变红色 出现白色沉淀,酚酞试液变红色 |
猜想正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液于试管中滴加少量的稀盐酸 | 无明显现象 | 猜想正确 |


科目:初中化学 来源: 题型:
| 方案 | 加入试剂 | 分离方法 | 方案评价 (行或不行,并说明理由) |
| 一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | 不行,引进新杂质硝酸钠 不行,引进新杂质硝酸钠 |
| 二 | 过量的HCl溶液 | 蒸发结晶 | 可行,HCl具有挥发性 可行,HCl具有挥发性 |
查看答案和解析>>
科目:初中化学 来源:2011年北京市朝阳区中考化学二模试卷(解析版) 题型:解答题
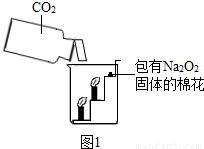
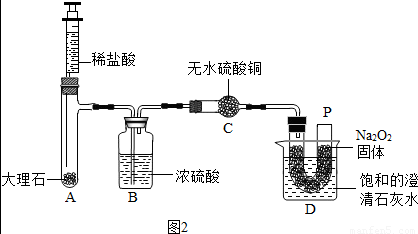
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com