
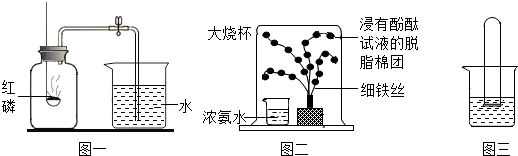
分析 (1)根据测定空气中氧气的含量的原理是燃烧物消耗空气中的氧气,然后生成物几乎不占空间,从而造成气压差,则进入的水就是消耗的氧气的量进行分析;
(2)从①浓氨水具有挥发性,挥发出的氨气是由氨分子构成的;②酚酞试液是一种酸碱指示剂,遇酸不变色,遇碱变红色;③氨水是碱性的,能够使酚酞试液变红;④保持物质化学性质的最小粒子是分子,保持氨气的化学性质的最小粒子是氨分子分析解答;
(3)二氧化碳能与水化合生成了碳酸,碳酸显酸性,能使紫色石蕊试液变成红色.据此分析回答有关的问题.
解答 解:(1)①因为红磷燃烧消耗空气中的氧气,氧气约占空气体积的$\frac{1}{5}$,故集气瓶中吸入水的体积约占集气瓶容积的$\frac{1}{5}$,根据在测定空气中氧气的体积分数时注意事项:装置的气密性要好;为了要耗尽瓶中的氧气,红磷必须是足量的;气体的体积受到温度的影响,要等到装置冷却至室温,再打开了弹簧夹等;因此可知达不到瓶中空气总体积的五分之一的原因可能是:装置漏气或红磷量不足或容器未冷却就打开止水夹.
②测空气中氧气的含量主要是根据物质燃烧消耗空气中的气体造成气压减小,减小的体积就是氧气的体积,故生成物中不能有气体,用碳代替红磷,碳燃烧生成物是二氧化碳气体,瓶内气压不变,故不会进入水;
(2)①浓氨水具有挥发性,挥发出的氨气是由氨分子构成的;②酚酞试液是一种酸碱指示剂,遇酸不变色,遇碱变红色;③氨水是碱性的,能够使酚酞试液变红;④由于分子是不断运动的,当氨分子运动到浸有无色酚酞试液的棉团时,和酚酞试液观接触,由于保持物质化学性质的最小粒子是分子,保持氨气的化学性质的最小粒子是氨分子;氨分子能使“铁树”上浸有无色酚酞试液的棉团由白色变成红色;
(3)向盛有紫色石蕊试液的试管中通入适量的CO2,紫色石蕊试液变成红色,是因为二氧化碳与水反应生成碳酸,生成的碳酸使紫色石蕊试液变成红色,反应的化学方程式为CO2+H2O=H2CO3;反应符合“多变一”的特点,属于化合反应.
故答案为:(1)①$\frac{1}{5}$;装置漏气; 红磷量不足或容器未冷却就打开止水夹; ②碳燃烧生成物是二氧化碳气体,瓶内气压不变.
(2)红;B;
(3)CO2+H2O=H2CO3;化合反应.
点评 本题考查了常见物质的性质,完成此题,可以依据已有的知识进行.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | FeO | B. | Fe3O4 | C. | Fe2O3 | D. | Fe2O |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 物 质 | 样 品 | 加入稀盐酸质量 | 反应后容器中物质的总质量 |
| 质量(g) | 6 | 40 | 43.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com