
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加 |
该溶液是碳酸钠溶液.有关反应的化学方程式为 |
| 0.18g |
| 100g+0.18g |
| 验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加 稀盐酸. | 有气泡冒出 | 该溶液是碳酸钠溶液.有关反应的化学方程式为 Na2CO3+2HCl=2NaCl+H2O+CO2↑. |


 优学名师名题系列答案
优学名师名题系列答案科目:初中化学 来源: 题型:
A、碳酸钙
| ||
B、铁+氧气
| ||
C、甲烷+氧气
| ||
D、氯酸钾
|
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
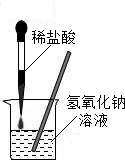 如图所示,小田同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂,导致无法判断该中和反应进行的程度.于是他对所得的溶液的酸碱性进行探究.
如图所示,小田同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂,导致无法判断该中和反应进行的程度.于是他对所得的溶液的酸碱性进行探究.| 实验操作 | 实验现象 | 结论 |
| 用试管取溶液1-2ml,滴入1-2滴无色酚酞试液,振荡 | 无色酚酞试液变 |
溶液呈碱性 |
| 无色酚酞试液不变色 | 溶液呈 |
查看答案和解析>>
科目:初中化学 来源: 题型:
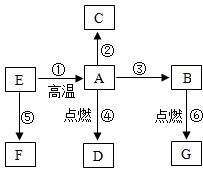 下列物质是初中化学常见的物质,A是常见的金属,②是湿法冶金的先驱,④的反应现象是火星四射,E是红棕色固体,F是黄色溶液,G是最常见的液体,这些物质之间的转化关系如图所示(部分反应物、生成物已省略):
下列物质是初中化学常见的物质,A是常见的金属,②是湿法冶金的先驱,④的反应现象是火星四射,E是红棕色固体,F是黄色溶液,G是最常见的液体,这些物质之间的转化关系如图所示(部分反应物、生成物已省略):查看答案和解析>>
科目:初中化学 来源: 题型:
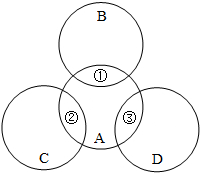 A、B、C、D分别是铁、盐酸、碳酸钠溶液、氢氧化钠溶液中的一种,其反应关系如图所示.图中两圆相交部分①②③表示两种物质之间反应的主要现象,其中①无明显现象,A与D反应的产物之一可作灭火剂.请思考下列问题:
A、B、C、D分别是铁、盐酸、碳酸钠溶液、氢氧化钠溶液中的一种,其反应关系如图所示.图中两圆相交部分①②③表示两种物质之间反应的主要现象,其中①无明显现象,A与D反应的产物之一可作灭火剂.请思考下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
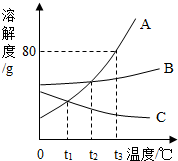 如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:
如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com