
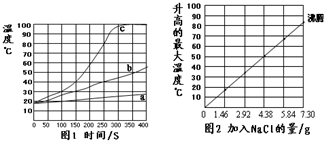
 无焰食品加热器常用于野外加热食物,它的成分是镁粉、铁粉、氯化钠.使用时加入水,镁和水反应产生热量.下面是在18℃、标准大气压的环境中对该产品的实验研究,请结合以下方案回答有关问题(不考虑氯化钠对水沸点的影响).
无焰食品加热器常用于野外加热食物,它的成分是镁粉、铁粉、氯化钠.使用时加入水,镁和水反应产生热量.下面是在18℃、标准大气压的环境中对该产品的实验研究,请结合以下方案回答有关问题(不考虑氯化钠对水沸点的影响).分析 根据所给信息和图象正确加以分析和整合;通过图一可知:镁的反应表面积越大反应速度越快,故温度变化较大;图2图象可知:加入氯化钠的质量与升高的最大温度成正比.镁粉比镁条能更快产生热量,在镁和铁质量相等的情况下,7.30g NaCl能使液体达到沸腾
解答 解:(1)金属镁与水反应是化学变化并放出热量;故答案为;化学;热.
(2)通过图一不难看出镁的反应表面积越大反应速度越快,故温度变化较大;图2图象可知:加入氯化钠的质量与升高的最大温度成正比;故答案为:镁的反应表面积(镁的颗粒大小、或镁的状态等合理答案均给分).
(3)图2图象可知当氯化钠的量为7.30g时液体沸腾;故答案为;C.
(4)图2图象可知如果在实验2中加入质量为3.65gNaCl,混合物的温度最高大约是40-50℃之间;故答案为;40-50℃之间.
(5)镁粉比镁条能更快产生热量,在镁和铁质量和前次实验相等的情况下,7.30g NaCl能使液体达到沸腾.故答案为;A;镁粉比镁条能更快产生热量,配方A中已达到水的沸点,配方C中多余的NaCl造成原料浪费.
点评 本题提供了较多的信息,学生应从较多的信息中寻找解决问题的方法;通过图象可以看出它考查了影响化学反应速率的因素和金属的化学性质.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| X盐溶液 | Y盐溶液 | Z盐溶液 | |
| Ni | 无 | 无 | 有 |
| Mn | 无 | 有 | 有 |
| A. | X Mn Y Ni Z | B. | Z Ni Y Mn X | ||
| C. | Z Mn Y Ni X | D. | X Mn Ni Y Z |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
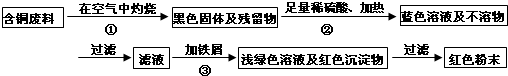
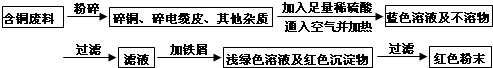
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | KClO3 氯酸钾 WO3 三氧化钨 O3 氧气 | |
| B. | KMnO4 锰酸钾 H2O 水 S 硫 | |
| C. | CuSO4 硫酸铜 Al2O3 氧化铝 He 氦气 | |
| D. | CaNO3 硝酸钙 FeO 氧化亚铁 H2 氢气 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CaO | B. | CO2 | C. | NaOH | D. | HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com