
某小组在实验室中用高锰酸钾受热分解制取氧气。
(1)写出该反应的化学方程式 。

(2)为组装制取氧气的装置(包括收集装置),请你从下图中选择所需的仪器,(填序号,下同) 。
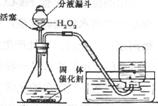
 (3)实验室里还可采用右图装置,通过分解过氧化氢(H2O2)的方法制取氧气。写出该反应化学方程式: ,
(3)实验室里还可采用右图装置,通过分解过氧化氢(H2O2)的方法制取氧气。写出该反应化学方程式: ,
收集氧气的方法还可以用 。
(4)比较两种方法,后一种方法的主要优点是:
。
 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:
| 实验 序号 |
H2O2溶液 浓度% |
H2O2溶液 体积/mL |
温度℃ | MnO2的 质量/g |
收集氧气的 体积/mL |
反应所需的 时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
| ④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com