
| 实验操作 | 实验现象 | 结论 |
| 取该溶液1-2ml与试管,滴如1-2滴无色酚酞试液,震荡 | 无色酚酞试液变红 | 溶液呈碱性 |
| 无色酚酞试液不变色 | 溶液呈中性或酸性性 |
| 实验操作 | 实验现象 | 结论 |
| 取样,加入碳酸钠溶液 - | 如果有气泡产生 | 溶液呈酸性 |
| 如果没有气泡产生 | 溶液呈中性 |
分析 氢氧化钠溶液呈碱性,能使酚酞变红,盐酸呈酸性,氢氧化钠与盐酸反应生成氯化钠和水,呈中性,在酸性和中性溶液中酚酞不变色,氢氧化钠能与某些物质反应生成沉淀,碳酸盐遇酸化气,活泼金属能与酸反应生成氢气.
解答 解:【提出猜想】盐酸与氢氧化钠混合,会发生反应,由于加入的酸的量不固定故溶液可能呈碱性、中性或酸性,所以本题答案为:中,酸性;
【实验验证】酚酞在碱性溶液中变红,在酸性和中性溶液中为无色,所以本题答案为:
| 实验操作 | 实验现象 | 结论 |
| 红 | ||
| 中性或酸性 |
| 实验操作 | 实验现象 | 结论 |
| 红 | ||
| 中性或酸性 |
| 实验操作 | 实验现象 | 结论 |
| 取样,加入碳酸钠溶液 - | 如果 有气泡产生 | 溶液呈 酸性 |
| 如果 没有气泡产生 | 溶液呈 中性 |
点评 本题考查了酸碱中和反应以及酸的检验方法,完成此题,可以依据物质的性质进行.


科目:初中化学 来源: 题型:填空题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 18 | 1 | 2 | 32 |
| 反应后质量/g | X | 26 | 2 | 12 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | a | b | c | d |
| 反应前质(g) | 10 | 10 | 10 | 2 |
| 反应后质(g) | X | 2 | 21 | 2 |
| A. | 该反应是化合反应,d可能是催化剂 | |
| B. | a、b两种物质中元素种类一定与c物质中元素种类相同 | |
| C. | b物质可能是单质 | |
| D. | X的值为3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 65% | B. | 42.8% | C. | 62% | D. | 45.2% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
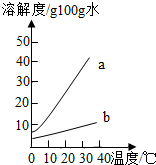 以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.
以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3的溶解度(g/100g水) | 7.1 | 12.5 | 21.5 | 39.7 | 49.0 |
| NaHCO3的溶解度(g/100g水) | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com