
【题目】用如下图装置测定空气中氧气含量(夹持装置已略去),左侧直玻璃管中液面以上平分为5份。
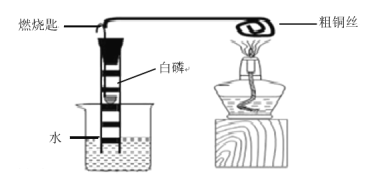
(1)加热铜丝可以引燃白磷,利用的是铜有良好的_______性。
(2)能证明空气中氧气含量的现象是________________________。
(3)用白磷能测定空气中氧气含量的原因是________。
科目:初中化学 来源: 题型:
【题目】进行如图实验,研究物质的性质。
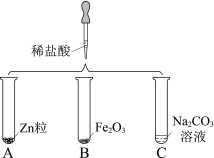
(1)A中的现象是______。
(2)B中反应的化学方程式为______。
(3)C中滴入稀盐酸后得到溶液甲,向甲中继续滴加Ca(OH)2溶液,有白色沉淀生成。溶液甲中的溶质是______(填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】进行如下实验,研究氢氧化钙的化学性质。
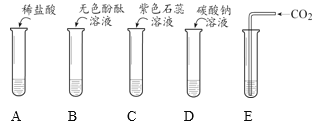
(1)溶液变为红色的是______(填序号)。
(2)没有明显现象试管中发生反应的化学方程式为______。
(3)两支试管中出现浑浊现象,其原因是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】依据下图所示实验回答问题。
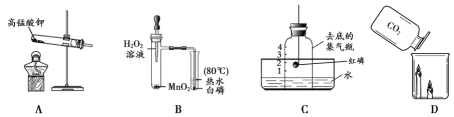
(1)A 中发生反应的化学方程式为__________。
(2)B用来探究燃烧的条件,由此得出燃烧的结论是__________。
(3)C中能证明空气中氧气含量的现象是__________。
(4)D中观察到的现象是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】完成下列变化的文字表达式,并按要求填空。
(1)用双氧水制取氧气(二氧化锰粉末作催化剂):_____,该反应是_____(选填“吸热”或“放热”)反应。
(2)实验室加热高锰酸钾制氧气的反应:_____,基本反应类型为_____反应。
(3)镁带在氧气中燃烧:_____,军事上镁可用作_____。
(4)二氧化碳与水的反应:_____,基本反应类型为_____反应。二氧化碳通入澄清石灰水:_____。
(5)铁丝在氧气中燃烧:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验小组同学在实验室用过氧化氢溶液制氧气。
(1)用过氧化氢和二氧化锰反应的化学方程式为:__________________________。
(2)同学们发现反应时有白雾产生,用如下两个装置来找原因,其目的是:___________。
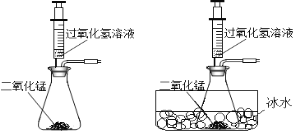
同时又展开了下列思考与探究:
(3)催化剂MnO2的用量对反应速率是否有影响呢?
他们做了这样一组实验:每次均用30mL10%的H2O2溶液,采用不同质量MnO2粉末做催化剂,测定各次收集到500mL氧气所用的时间,结果如下:(其它实验条件均相同)
实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
MnO2粉末用量(克) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
所用时间(秒) | 17 | 8 | 6 | 3 | 2 | 2 | 2 | 2 | 2 | 2 |
请根据表中数据回答,MnO2粉末的用量对反应速率的影响是___________。
(4)H2O2溶液的溶质质量分数对反应速率是否有影响呢?小组同学又做了一组实验:
每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验。记录数据如下:(实验均在20℃室温下进行,其它实验条件均相同)
实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
H2O2溶液溶质质量分数 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
MnO2粉末用量(克) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
收集到540mL气体时所用时间(秒) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
分析表中数据可得出的结论是___________。
(3)实验反思:MnO2颗粒的大小对反应速率是否有影响?请设计实验证明(语言叙述,不用画装置图)___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验设计能够实现其对应实验目的是( )
A. 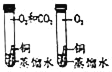 探究CO2对铜生锈是否有影响
探究CO2对铜生锈是否有影响
B. 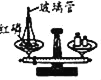 验证质量守恒定律
验证质量守恒定律
C. 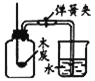 测定空气中氧气含量
测定空气中氧气含量
D. 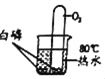 验证燃烧需要温度达到着火点
验证燃烧需要温度达到着火点
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将一定质量的Mg、Al合金投入100g一定浓度的盐酸中,合金全部溶解,向所得溶液中滴加NaOH溶液至过量,生成沉淀的质量与加入NaOH的质量关系如图所示。(已知:Al(OH)3沉淀能与NaOH溶液反应,反应方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,Mg(OH)2沉淀不能与NaOH溶液反应。)求:
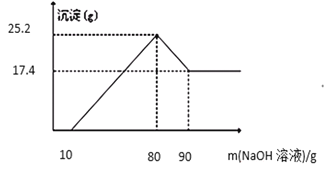
(1)Al(OH)3的质量为_____________克
(2)原合金中Mg和Al的质量比为______(化为最简单整数比);
(3)所用盐酸的质量分数为_____?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
酵素食品富含大量的酶、乳酸、乙酸及少量乙醇等物质,具有促进人体新陈代谢、调节人体肠道与抗氧化等功效。研究人员对西兰花酵素发酵过程中变化及其抗氧化活性进行研究。
西兰花酵素制备过程如下:

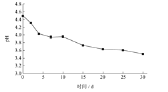
西兰花酵素在发酵过程中 pH 变化情况,如图所示。
发酵过程中添加的糖原为苹果汁,主要为葡萄糖与果糖。实验中,以葡萄糖与果糖之和表示西兰花发酵液中的总糖消耗情况。总糖、乙醇、乳酸和乙酸含量变化如下图所示。
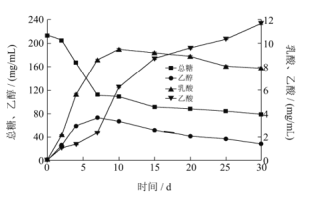
酵素发酵过程中,糖原主要被酵母和乳酸菌消耗,醋酸杆菌主要利用乙醇进行代谢,因此糖在前期消耗快,后期平缓减低。
监测发酵过程中西兰花酵素抗氧化性变化情况。发现发酵过程中抗氧化性前7 天增加,7 天后趋于平稳,其抗氧化性测定指标相较于抗氧化性高的桑葚酵素高,是一种口感柔和,味道酸甜,抗氧化性好的酵素食品。
依据文章内容回答下列问题。
(1)酵素食品属于___________(填“纯净物”或“混合物”)。
(2)西兰花酵素的制备过程中搅拌的作用是_____________。
(3)依据如图,判断西兰花酵素的制备过程中液体2的酸碱性___________(填序号,下同)。
A 酸性 B 中性 C 碱性
(4)结合如图,分析发酵液pH值不断降低的原因_____________。
(5)下列说法正确的是 ____________。
A 酵素发酵过程中,糖原被不断消耗,最终为零。
B 西兰花酵素食品中含有少量乙醇。
C 西兰花酵素发酵过程中,抗氧化性持续增强。
D 西兰花酵素是一种口感柔和,味道酸甜,抗氧化性好的酵素食品。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com