
【题目】为了探究金属和盐溶液的反应规律,将一定质量的锌粉和银粉加入到硝酸铜溶液中,充分反应,实验过程及实验现象如下图所示,则下列说法中正确的是
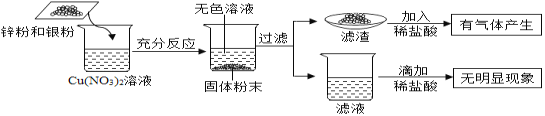
A. 滤渣中可能含单质锌B. 滤渣中一定含有Cu、Ag、Zn
C. 滤液中一定含有Zn2+和Ag+D. 充分反应后溶液质量减少
【答案】B
【解析】
金属活动性顺序中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来,将一定质量的锌粉和银粉加入到硝酸铜溶液中,则锌粉与硝酸铜溶液反应,Zn+Cu(NO3)2= Zn(NO3)2 + Cu,如果充分反应后,得到无色溶液,则硝酸铜完全参加反应无剩余。
A. 向滤渣中加入稀盐酸,有气体产生,则滤渣中含有锌,此选项错误;
B. 滤渣中一定含有生成的Cu、没参加反应的Ag、过量的Zn,此选项正确;
C. 滤液中的溶质是Zn(NO3)2,所以一定含有Zn2+,银没有参与反应,无Ag+,此选项错误;
D. 将一定质量的锌粉和银粉加入到硝酸铜溶液中,则锌粉与硝酸铜溶液反应,Zn+Cu(NO3)2= Zn(NO3)2 + Cu,充分反应后,固体质量减少,则溶液质量增多,此选项错误。故选B。


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:初中化学 来源: 题型:
【题目】某工厂现有废硫酸9.8 t(H2SO4的质量分数为10%),试计算:
(1)该9.8 t废硫酸中H2SO4的质量多少t;
(2)如果用该9.8 t废硫酸去中和处理另一工厂的废碱液(主要成分为NaOH),恰好中和废碱液20 t,求废碱液中NaOH的质量分数。(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铼高温合金材料用于制造航空发动机。在元素周期表中铼元素的某些信息如图所示。下列有关铼的说法错误的是

A. 原子序数为 75B. 属于金属元素
C. 原子核内中子数为 75D. 相对原子质量为 186.2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学家发现,中草药成分中提取的“汉防己碱”能有效避免病毒进入细胞,有助于预防埃博拉感染,其分子式为C38H42N2O6.请回答:
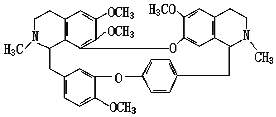
(1)汉防己碱属于_____(填“无机物”或“有机物”);
(2)汉防己碱由_____种元素组成,1244gC38H42N2O6中含氮_____g;
(3)汉防己碱中碳元素与氧元素的质量比是_____(化成最简比)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镁合金广泛用于航空航天、导弹、汽车、建筑等行业。镁元素的相关信息如图所示。请回答下列问题:
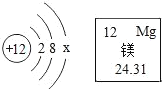
(1)镁原子的质子数为_____,x值为_____。
(2)镁属于元素_____(填“金属”或“非金属”),金属镁在化学反应在容易_____(填写“得到”或“失去”)电子。
(3)海水中含有丰富的氯化镁,目前工业上绝大多数的金属镁是从海水中提取的,其生产流程如图:
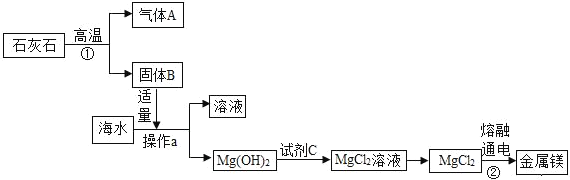
在上述流程中,通过操作a分离出固体Mg(OH)2,操作a的名称是_____,试剂C为:_____。
反应①的化学方程式为_____。
反应②的化学方程式为_____。
(4)上述流程中没有涉及到的基本反应类型是_____反应。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碱式碳酸盐广泛应用于工农业生产。
(查阅资料)①碱式碳酸铜可以表示为Cu(OH)2·mCuCO3,是常见的碱式碳酸盐。
②碱式碳酸盐M(OH)2·MCO3不溶于水,与碱式碳酸铜具有相似的化学性质。
③无水硫酸铜是白色粉末,能与水作用生成蓝色固体。
(1)研究小组欲确定某碱式碳酸盐样品M(OH)2·MCO3中金属M的相对原子质量。
(实验装置)
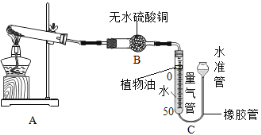
(实验步骤)
①连接装置并检査装置气密性;②准确称量样品的质量;③装药品,调节量气装置两边液面相平,读数;④点燃酒精灯,加热样品至质量不再减少;③冷却到室温;⑥调节量气装置两边液面相平,读数、列式计算。
I.步骤①中检査装置气密性的方法是_____________。
Ⅱ.装置B的作用是________,装置C中植物油的作用是____。
Ⅲ.步骤⑥中调节液面相平的操作是将水准管_____(填“缓慢上移”或“缓慢下移”)。
Ⅳ.若其它操作均正确,仅因下列因素可使M相对原子质量的测定结果偏大的是_____(填序号)。
a.反应前量气管水面在0刻度处,反应后仰视读数 b.样品未分解完全即停止实验
c.量气管中未加植物油
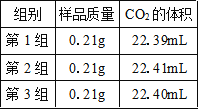
(2)某研究小组仍使用上述装置測定m的值,测得3组数据如表所示。实验测得CO2的体积为__________mL,又已知常温常压下CO2的密度为1.964g/L,据此计算m的值为______(结果保留两位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NH4Cl和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度 S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
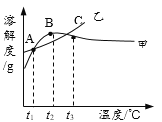
A. 甲为NH4Cl
B. t3℃应介于30℃~40℃
C. 乙物质的饱和溶液从t2升温到t3,溶液的溶质质量分数不变
D. 甲、乙饱和溶液从t3降温到t1,析出晶体(均不带结晶水)的质量一定相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】电解法制铝的尾气处理工艺不仅能消除有害气体氟化氢(HF),还能实现物质的循环利用。主要物质转化关系如下图所示:
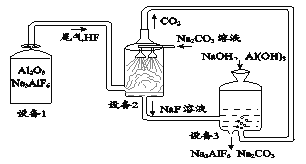
(1)设备I中, Na3AlF6的作用为降低氧化铝的熔点。Na3AlF6中氟元素(F)的化合价为 。
(2)设备2中,通过喷淋碳酸钠溶液可除去尾气中的氟化氢(HF),该反应的产物除水外,还有 。
(3)设备3所得的Na3AlF6和Na2CO3 (填“能”或“不能”)循环使用。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某白色固体是CuSO4、CaCO3、Ba(NO3)2、Na2SO4、NaOH中的一种或几种.为确定其组成,同学们进行了如下实验.
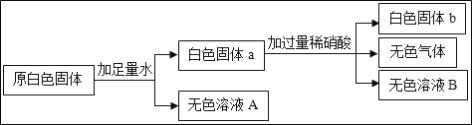
(1)原固体中一定没有___;
(2)实验过程中产生气体的化学方程式为___;
(3)无色溶液B中的溶质是___;
(4)原固体中可能存在的物质是___,要确定其是否存在,还需进行的实验是___.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com