
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| MnO2与KClO3的质量比 | 1:40 | 1:20 | 1:10 | 1:5 | 1:3 | 1:2 | 2:3 | 1:1 | 2:1 |
| 生成1LO2所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 二氧化锰与氯酸钾的质量比 |
|
|
|
|
|
|
|
|
| ||||||||||||||||||
| 生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
| 验实 号编 |
试剂 | 前 10min 内产生 的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:
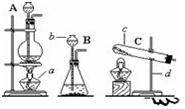
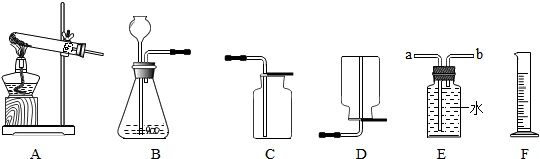
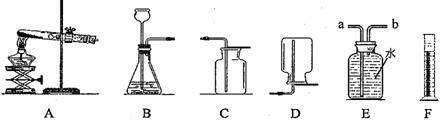
根据下列实验装置图,回答问题。

(1)写出上图中标有序号的仪器名称:①___________,②___________。
(2)利用A装置制取氧气反应的文字表达式为___________;其中A装置中试管口略向下倾斜的目的是___________;在进行制取氧气的操作时,加入药品之前必须进行的一步操作是___________。
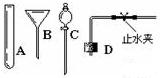
(3)查阅资料:相同条件下,氨气(NH3)的密度比空气小,且易溶于水,其水溶液称为氨水;加热氯化铵和氢氧化钙固体混合物可制取氨气。
根据所查资料,制取氨气应选择的收集装置是___________(填序号,如果没有合适选项请选E并在方框中画出合适的装置)。
(4)下表是某同学利用氯酸钾和二氧化锰制取氧气时测定的实验数据。
| MnO2与KClO3的质量比 | 1:40 | 1:20 | 1:10 | 1:5 | 1:3 | 1:2 | 2:3 | 1:1 | 2:1 |
| 生成1LO2所需的时间(s) | 124[来源:学科网] | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
①据上表可知二氧化锰与氯酸钾的质量比为___________时,反应速率最快;
②二氧化锰的用量过少时产生氧气的速率很慢,可能原因是___________;
③通过上述数据分析可知,在化学反应中催化剂的用量___________
(填“是”或“不是”)越多越好。
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
某化学兴趣小组回收利用废旧干电池。
实验 1 回收填料中的二氧化锰和氯化铵
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。兴趣小组的同学们设计回收物质的流程如下图所示。
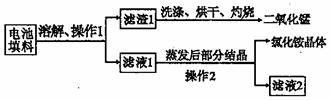 |
(1)操作 1 的名称是 ▲ ,该操作中玻璃棒的作用是 ▲ 。
(2)灼烧滤渣 l 的目的是  ▲ 。
▲ 。
(3)二氧化锰是氯酸钾受热分解的催化剂,下表是他们的有关实验数据,请你回答有关问题:
| 二氧化锰与氯酸钾的质量比 | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
| 生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
①据上表可知二氧化锰与氯酸钾的质量比为 ▲ 时,反应速率最快。分析可知反应前后二氧化锰在固体混合物中质量分数是 ▲ (“不变”或“变大”或“变小”)。
②二氧化锰的用量过少时产生氧气的速率很慢,原因是 ▲ ;二氧化锰用量过多,产生氧气的速率 ▲ (填“变快”、“变慢”或“不变”),通过分析可知,在化学反应中催化剂的用量 ▲ (填“是”或“不是”)越多越好。
实验 2 利用外壳回收物锌制取氢气及相关探究
(4)用锌粒和稀硫酸可制取氢气(锌+硫酸→硫酸锌+氢气)。己知氢气密度比空气小且难溶于水,提供装置如下图:应选择:发生装置为 ▲ (填编号),排空气法收集装置为 ▲ (填编号)。
(5)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前 10 min 内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
| 验实 号编 | 试剂 | 前 10 min 内产生 的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30 mL 30 % | 564.3 |
| b | 含杂质的锌 | 30 mL 30 % | 634.7 |
| c | 纯锌 | 30 mL 20 % | 449.3 |
| d | 纯锌 | 40 mL 30 % | 602.8 |
①比较实验 a 和实验 b ,可以得到的结论是 ▲ 。
②为了研究硫酸浓度对反应快慢的影响,需比较实验 ▲ 和实验 ▲ (填编号)。
③控制其他条件相同,需控制的条件是 ▲ (例举一种条件即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com