
【题目】某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g,把100 g稀盐酸分5次加入,测量过程所得数据见下表(已知石灰石样品中杂质不溶于水,不与稀盐酸反应),各次稀盐酸用量和反应后剩余固体质量记录如下:
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
实验后剩余固体的质量/g | 13 | 10 | 7 | 6 | m |
请回答:
(1)上表中m的数值为 。
(2)石灰石样品中碳酸钙的质量分数为多少?
(3)在第5次实验后的溶液中,再加人足量的该石灰石样品粉末,完全反应后过滤,求所得溶液的溶质质量分数。(假设实验过程中溶液损失忽略不计)
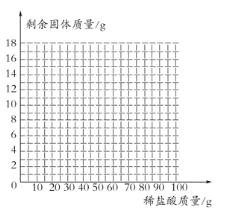
(4)画出16g样品中加入稀盐酸的质量和剩余固体的质量关系的示意图 (不用写出计算过程。)
(5)第一次加入20 g盐酸的反应速率为ν1,第二次加入20g盐酸的反应速率为ν2,则ν1 ν2(选填“>”“<”或“=”)。
【答案】(1)6;(2)62. 5%(3)15. 36%(4)如图
(5) >
【解析】
(1)根据图表数据可知,第1、2次反应后固体物质减少的质量都为3g,而第3次反应后固体物质减少的质量为1g,说明此时碳酸钙已反应完,固体质量不再改变,故表中m的数值为6。
(2)石灰石样品中杂质不溶于水,不与稀盐酸反应,故反应中减少的固体质量即碳酸钙质量,反应中石灰石样品中碳酸钙的质量分数为![]() 。
。
(3)根据题干中数据,设盐酸的质量分数为x,按盐酸全部反应的数据即可计算,根据第1次消耗的碳酸钙的质量16g-13g=3g计算

![]()
解得x=10.95%
设第5次实验后,再加人足量的该石灰石样品粉末,此时100g盐酸完全反应,设生成氯化钙的质量为y,生成二氧化碳的质量为z,参加反应的碳酸钙的质量为m,

![]()
![]()
![]()
解得y=16.65g,z=6.6g,m=15g
反应后氯化钙的质量分数为:![]()
(4)根据表格中信息知,每20克该浓度的盐酸与3克碳酸钙恰好反应,16g样品中碳酸钙的质量是10g,消耗盐酸的质量为:![]() ,16g样品中加入稀盐酸的质量和剩余固体的质量关系的示意图如下:
,16g样品中加入稀盐酸的质量和剩余固体的质量关系的示意图如下:

![]()
(5)固体反应物的状态、溶液的浓度,反应的温度等都会影响反应速率,第一次加入20 g盐酸的反应速率为ν1,反应消耗掉氯化氢,剩余水,第二次加入20g盐酸,加入盐酸后的浓度小于第一次加入盐酸的浓度,故反应速率为ν1>ν2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】将锌粉和铁粉加入一定量的硝酸铝和硝酸银的混合溶液中,充分反应后过滤。
(1)写出一定发生的反应的化学方程式。_____
(2)若滤液呈浅绿色,请写出所得固体中一定没有的金属。_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
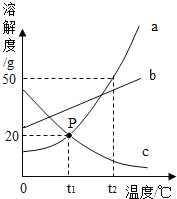
(1)P点的含义是______。
(2)t2°C时,30ga物质加入到50g水中不断搅拌,充分溶解后形成溶液的质量是___g,此时a的溶质质量分数为____。
(3) t2°C时,a、 b、c三种物质的溶解度由小到大的排列顺序是___。
(4)将t1°C的a、b、c三种物质饱和溶液的温度升高到t2C时,三种溶液的溶质质量分数的大小关系是___
A c>a=b
B a=b>c
C a>b>c
D b>a>c
(5)t2°C时,将c的饱和溶液变成不饱和溶液,可采取的方法是__(任填一种方法)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲物质的溶液可用作化肥、电镀液等。甲的溶解度曲线如图所示,下列说法正确的是

A.甲的溶解度是102.5g
B.甲的溶解度随温度的升高而增大
C.20℃时,100 g甲的饱和溶液中溶质质量为28.6 g
D.将70℃甲的饱和溶液升高温度或降低温度,都有晶体析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】初中化学常用的实验装置如下图所示。请根据装置图回答下列问题:.
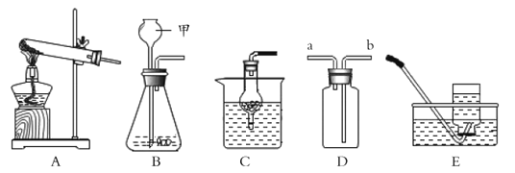
(1)写出标号仪器名称:甲_____________。
(2)实验室制取氧气时,发现酒精灯酒精不足,应该用____________(填仪器名称)往酒精灯里添加酒精。
(3)利用装置B制取氧气的化学方程式为_____________,为了制取干燥的氧气可选用的装置是__________(填装置字母)
(4)写出实验室制取二氧化碳的药品名称:_____________。装置C比装置B优越之处在于_____________;若用装置C来制取氢气,其装置气密性检查方法如下:_____________,往烧杯中加水,如果__________证明装置漏气。
(5)如图是实验室制备干燥的CO2的装置,请把图补画完整_______。
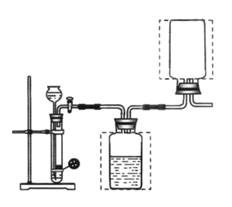
(6)如果用大理石和稀盐酸制取二氧化碳实验后,取过滤后少量溶液加入紫色石蕊试液,紫色石蕊试液变红。另取过滤后少量溶液不断滴加碳酸钠溶液,所发生的实验现象是_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图所示是实验室常用的一些仪器,回答图后面的问题。
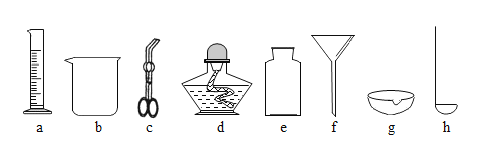
(1)根据以下实验要求,选择图中合适仪器,将编号填在相应的横线上。
①给体积约为90 mL的硝酸钾溶液加热:________;
②用固体氯化钠配制一定溶质质量分数的氯化钠溶液:__________;
③过滤粗盐水:________。
(2)除了图中的仪器,(1)中的②、③两个实验都还要用到的一种仪器是(填仪器名称)________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以MnO2为原料制备MnSO4H2O的工业流程如图。
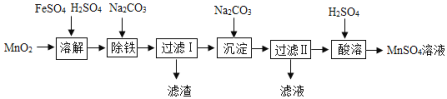
已知:①沉淀时的化学方程式为7MnSO4+7Na2CO3+11H2O=MnCO36Mn(OH)25H2O↓+7Na2SO4+6CO2↑
②MnSO4H2O和MnSO45H2O易溶于水,难溶于乙醇。
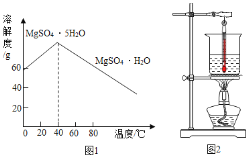
③MnSO4的溶解度曲线如图1所示。
(1)溶解时,为控制80℃,在实验室可用水浴加热如图2.水浴加热需要的玻璃仪器有酒精灯、① _____、_____。水浴加热的优点有②_____________。能加快溶解的方法有③_________(写一种)。
(2)除铁时需要搅拌,搅拌的作用是____________。
(3)过滤I所得滤液的溶质主要是Na2SO4和____________。
(4)酸溶时,MnCO36Mn(OH)25H2O与足量稀硫酸反应的化学方程式为___________________。
(5)请补充完整由流程中“酸溶”所得MnSO4溶液制备MnSO4H2O的实验方案:将MnSO4溶液转移至蒸发皿中,___________,在高于40℃时趁热过滤,____________,100℃烘干得MnSO4H2O。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组同学在学习中和反应后,做了如下实验:
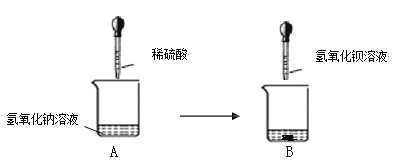
【观察与讨论】甲同学观察到 B 烧杯中出现___________ 现象,于是甲同学认为氢氧化钠和稀硫酸发生了反应。乙同学不同意甲同学的观点,其理由是________;
为了科学处理废液,同学们对 B 烧杯中上层溶液里的溶质成分进行了探究。
【提出问题】B 烧杯中溶液里的溶质含有什么物质?
【猜想与假设】甲同学猜想:Na2SO4
乙同学猜想:Na2SO4、NaOH
丙同学猜想:NaOH 、Ba(OH) 2
丁同学猜想:Na2SO4、H2SO4
【实验探究】甲同学实验:取 B 烧杯中溶液少许于试管中,向其中先滴加几滴无色酚酞试 液,溶液变成红色,然后再加入足量的稀硫酸,观察到____________________现象,于是甲同学认为乙同学猜想正确。请你评价甲同学的实验及结论_____________________;
乙同学实验:取 B 烧杯中溶液少许于试管中,向其中滴加硝酸钡溶液,观察到有白色沉淀生成,乙同学结合甲同学实验确定了溶液中溶质为 ___________填化学式);
同学们根据探究结果合理的处理了废液。
【反思与总结】
a.通过甲同学实验可知,判断无明显现象的中和反应发生了,可以通过实验验证 _______ 即可;
b.通过上述探究过程可知,猜想反应后溶液中溶质成分时,不仅要考虑可溶于水的反应物及生成物,还要考虑_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了测定某钢中铁的质量分数,某同学进行了下列实验:取10.0g粉碎的钢样品放入烧杯中,将122.5g稀硫酸分5次加入该烧杯中,充分反应后(假设杂质不溶于水,也不与酸反应) ,测得剩余固体的质量数据记录如下:
次数 | 1 | 2 | 3 | 4 | 5 |
加入稀硫酸的质量/g | 24.5 | 24.5 | 24.5 | 24.5 | 24.5 |
剩余固体的质量/g | 7.9 | 5.8 | 3.7 | a | 0.2 |
请计算:
(1)H2SO4中硫、氧元素的质量比为 (填最简整数比)。
(2)表格中a的值为 。
(3)该钢样品中铁的质量分数为 。
(4)所加稀硫酸的溶质质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com