
(10分)为探究气体X的组成,某兴趣小组进行图12所示实验(固定装置未画出)。
【资料在线】
(1)加热条件下,气体X能与氧化铜反应生成铜、水和氮气。
(2)碱石灰为固体氢氧化钠和氧化钙的混合物,不与气体X反应。
无水氯化钙可吸收气体X。
(3)本实验条件下,氮气密度为1.15g·L-1,装置内空气中的水与二氧化碳对相关数据测定的影响可忽略不计。
【实验步骤】
(1)连接仪器,并检查装置气密性。
(2)取一定量氧化铜,准确称得其质量为2.40g。
(3)按图12所示装入药品,测量并记录相关数据Ⅰ(见表1)。
(4)连接A、B、C装置, 将气体X缓缓通入一段时间后,连接上D装置,读数后开始加热。当A装置中氧化铜反应完全,停止加热,继续通入气体 X至玻璃管冷却,再次测量并记录相关数据Ⅱ(见表1)。
【实验装置】
【相关数据】
【回答问题】
(1)B装置中氧化钙吸水的原理为 (用化学方程式表示)。
(2)实验过程中,当观察到 ,说明氧化铜已反应完全,停止加热,继续通入气体X至玻璃管冷却的目的是 。
(3)分析实验测量的数据,生成水的质量为 g,氧化铜中氧元素的质量为 g。
由此推知,气体X中一定 (填“有”或 “没有”)氧元素。
(4)通过计算推导出气体X的化学式。
(1)CaO+H2O==Ca(OH)2 (2)量气管内液面不再下降 防止灼热的铜被氧化
(3)0.54 0. 48 没有 (4)NH3
解析试题分析:(1)氧化钙吸水是因为氧化可与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O==Ca(OH)2
(2)根据资料在线中的内容可知:因气体X可与氧化铜在加热的条件反应生成铜、水蒸气和氮气;当所有的气体通过B装置时,水蒸气被吸收;再通过C装置时,多余的X气体被吸收;则进入D装置内的气体为反应生成的氮气。随着氮气进入D装置,可造成其中的气体增多,气压变大,会观察到液面下降。所以当观察到量气管内液面不再下降时,说明不再生成氮气,即可说明氧化铜已反应完全。继续能入气体X是防止灼热的铜与其它物质反应而被氧化。
(3)根据上面的分析,结合表1可知:装置B的作用是吸收生成的水,所以装置B的质量增加值则为生成水的质量;即102.54g—102.00g=0.54g。在玻璃管中原为氧化铜,反应结束后其成分为铜单质, 所以其质量减少值则为氧化铜中氧元素的质量,即为52. 40g—51.92g= 0.48g(也可根据氧化铜的质量求出氧元素的质量)。进一步可根据装置B测出的水的质量,结合水的化学式(H2O),可求出其中氧元素的质量为:0.54g×( )=0.48g。二者求出的氧元素的质量相同,可说明在气体X中没有氧元素。
)=0.48g。二者求出的氧元素的质量相同,可说明在气体X中没有氧元素。
(4)根据上述分析可知该气体中只含氮元素和氢元素,且可根据氮气的质量求出其中氮元素的质量;可根据生成水的质量求出其中氢元素的质量。然后可根据氮元素与氢元素的质量比求出气体中氮氢元素的原子个数比,即可确定其化学式。具体计算过程如下:
解:设该气体的化学式为NxHy,根据题意可知:
14x:1y=(0.2435L×1.15g/L):(0.54g—0.48g)
x:y=1:3
所以该气体的化学式为NH3
考点: 实验方案的设计与评价、根据化学式的计算


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:初中化学 来源: 题型:填空题
氢化钙(CaH2)固体是一种储氢材料,登山运动员常用其作能源提供剂。
【查阅资料】
①碱石灰是氧化钙和氢氧化钠的固体混合物.
②钙和氢化钙都能与水反应,均生成氢氧化钙和氢气.
【氢化钙的制备】
氢化钙通常用氢气与钙加热制得.某化学兴趣小组设计的制取装置如图所示(图中固定装置省略).
(1)装置A中制取氢气反应的化学方程式是 .
(2)装置B的作用是 .
(3)装置D的作用是 .
(4)装置C中制取氢化钙的化学方程式是 .
【样品成分的猜想】通过上述方法制得的氢化钙样品的成分有下列两种猜想:
猜想一:全部是氢化钙; 猜想二: .
【设计实验】现有2.1g氢化钙样品,请设计实验验证猜想二是否成立 (要求操作、数据和结论).
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
研究性学习小组测定实验室里一瓶久置的NaOH固体是否变质.
【提出问题】NaOH固体是否变质?
【猜想与假设】猜想1:没变质,全部是NaOH;
猜想2:全变质,全部是Na2CO3
猜想3:部分变质,既含有NaOH,又含有Na2CO3;
【设计方案并进行实验】请你与他们一起完成,并回答所给问题.
| 实验步骤 | 实验现象 | 实验结论 |
| ①称取上述固体样品8g溶于100mL水配成溶液,向溶液中滴加 过量的氯化钙溶液充分反应后,静置. | _________ | 说明久置固体中,一定含有Na2CO3 |
| ②用玻璃棒蘸取少量①中的上层清液滴在pH试纸上,与标准比色卡对比,测出pH | pH=10 | 说明固体中,还一定含有 _________ (填化学式). |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
(7分)实验是科学探究的重要方法。如图是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题。
装置一 装置二
(1)根据下表提供的实验数据,完成下表
| 硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 25mL | 15mL | 9mL | |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
(5分)化学兴趣小组同学在实验室发现了四瓶长期存放且失去标签的溶液,现标为A、B、C、D,分别是碳酸钠溶液、氯化钡溶液、氢氧化钠溶液和稀硫酸中的一种。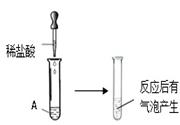
【提出问题】如何区分出四种溶液?
【进行实验】组长楠楠同学的实验如图所示:
【表达与交流】楠楠同学取少量A溶液,滴加足量的稀盐酸,观察到溶液中有气泡产生,楠楠同学由此得出结论:A是碳酸钠溶液。
萍萍同学不同意楠楠的观点,她的理由是(1) 。
经过交流,两人一起制订了新的实验方案:另取少量A于试管中,向其中滴加 (2) 溶液,观察到的明显现象是(3) ,
过滤后,取清液滴加无色酚酞溶液,溶液变为红色,由此证明了楠楠同学的结论是错误的,同时确定了A。
两位同学取B、C、D样品继续进行实验,如图所示:
【收集证据】观察到B中无明显现象,C中紫色石蕊溶液变红,D中紫色石蕊溶液变蓝。
【解释与结论】通过实验,两位同学最终区分出了四种溶液。请将B、C、D三瓶溶液中
溶质的化学式分别标在试剂瓶的标签上(4)
【反思与评价】你认为楠楠和萍萍两位同学在上述实验过程中表现出的长处是
(5) 。(写一点即可)
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
化学兴趣小组设计的创新实验是“火龙生字”.在成果展示现场,某同学用硝酸钾的热饱和溶液先在白纸上书写“火”字,晾干后白纸上出现硝酸钾晶体(见图1).用带火星的木条接触硝酸钾晶体,就会观察到白纸上写过字的地方燃烧并迅速蔓延,留下“火”字的黑色痕迹(见图2).在场的同学对此产生了浓厚的兴趣,并进行了如下研究:
【提出问题】为什么附有硝酸钾的白纸更容易燃烧?
【查阅资料】硝酸钾受热易分解,生成亚硝酸钾(KNO2)和一种常见的气体单质.
【猜想与假设】对于生产的是什么气体,四位同学有如下猜测:
甲:二氧化氮; 乙:氮气; 丙:氧气; 丁:氢气;
同学丙指出不可能是二氧化氮、氢气,理由是: 、 。
【进行实验】四位同学设计了实验对同学丙的猜想进行了验证,他们的操作方法是:
,观察到的现象是 ,说明同学丙的猜想正确.硝酸钾分解的化学方程式是 。
【解释与结论】白纸上写过字的地方更容易燃烧的原因是:
【反思与评价】为什么要用“硝酸钾的热饱和溶液”书写文字?
已知硝酸钾在不同温度时的溶解度如下表:
你对上述问题的解释是: 。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
(8分)常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。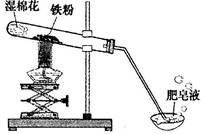
(1)试管尾部放一团湿棉花的目的是_______________。
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。 说明生成的气体是______________。
(3)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
| 实验操作 | 实验现象及结论 |
| | |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
(8分)有位化学教师取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂,于是请同学们进行了如下探究:
(1)取一定量样品于烧杯中,加入适量的水充分搅拌,用手触摸烧杯外壁,无明显现象。由此说明该样品中不含有 ;
(2)对该样品成分进行了如下猜想:
猜想① Ca(OH)2 猜想② Ca(OH)2和 CaCO3的混合物 猜想③ CaCO3
以下是某同学对猜想②进行的探究,请你补充完成实验报告
| 实验操作 | 预期现象与结论 |
| | , 说明固体中含有Ca(OH)2。 |
| | , 说明固体中含有CaCO3。 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
(8分) 碳酸氢钠是一种用途广泛的盐,某实验小组的同学设计了以下实验,以探究碳酸氢钠的性质。
【探究实验1】碳酸氢钠的物理性质:用 (写仪器名称)取少量固体放入试管中,加入适量水充分振荡。现象:固体为白色粉末,加水后固体 。结论:碳酸氢钠能溶于水。
【探究实验2】碳酸氢钠溶液的酸碱性:在上述溶液中滴入几滴酚酞试液,振荡。
现象:溶液变成红色。由此得出的结论是 。
【探究实验3】能否与酸反应:取少量固体放入试管中,加入稀盐酸,现象为
。结论:碳酸氢钠能与酸反应。
【探究实验4】碳酸氢钠的热稳定性:用如图所示
装置进行实验。大试管口略向下倾斜的原因是
;
现象:充分加热后,大试管壁上有水珠出现,管底有
白色固体残留,小试管中澄清石灰石变浑浊;结论:
碳酸氢钠受热能分解,分解的反应方程式是
;
验证:请你帮他们设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH,实验方法和现象是 。
【拓展应用】试说出碳酸氢钠在日常生活中的一种用途 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com