
某温度下,若X、Y、Z三种物质的饱和溶液中,溶质的质量分数的关系是X<Y<Z,则该温度下,三种物质的溶解度的关系是________.
 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:阅读理解
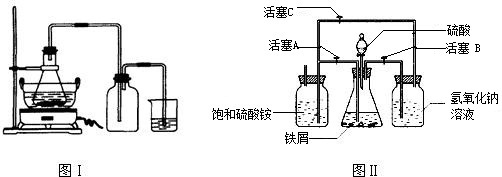
| 序号 | 反应物用量(n表示微粒个数) | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于1级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于1级 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
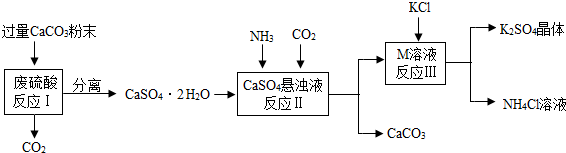
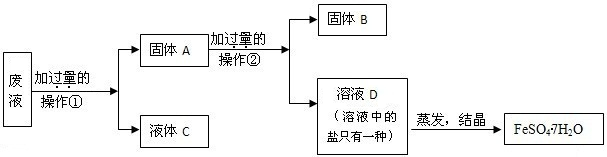
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
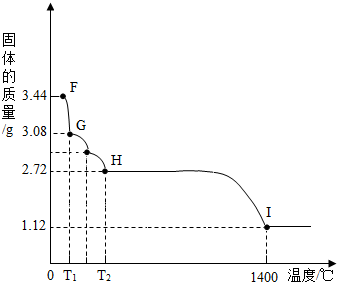
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |


查看答案和解析>>
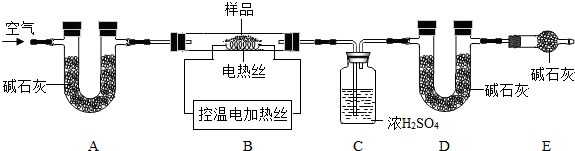
科目:初中化学 来源:2010年山东省中考化学全真模拟试卷(五)(解析版) 题型:解答题
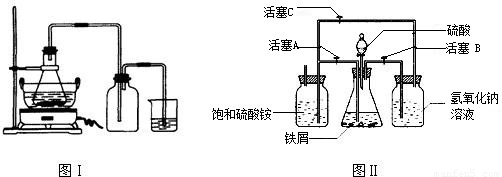
| 序号 | 反应物用量(n表示微粒个数) | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于1级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于1级 |
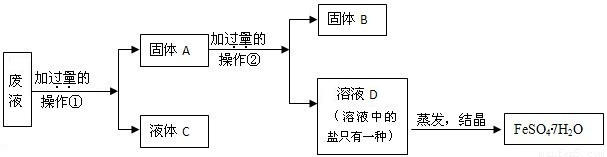
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com