
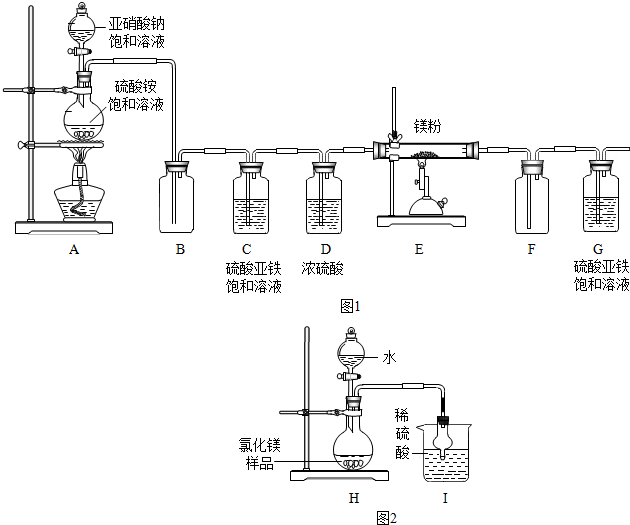
分析 (1)装置内含有氧气、反应生成的气体中可能含有氮的氧化物,装置C除去氧气(及氮氧化物)、D干燥氮气,防止对E装置反应的影响;
(2)装置E中氮气与镁反应生成氮化镁;
(3)根据进行实验时先进行A处加热,为了排尽空气解答;
根据化学方程式的书写方法以及化合价的计算方法来分析;根据氮化镁水解生成氢氧化镁沉淀与氨气,氨气使湿润的红色石蕊试纸变蓝,据此设计证明有氮化镁生成;若Mg有剩余,将上述反应后的上清液去掉,加入盐酸,有气泡生成,说明有Mg剩余解答;
(4)根据I装置增重3.4克为氨气的质量,利用化学方程式分析解答;
(5)根据球形干燥管的作用是充分反应,防倒吸解答.
解答 解:(1)浓硫酸具有吸水性,能够吸收水蒸气(干燥氮气);G装置的作用是防止空气中的氧气进入E装置;D干燥氮气,除去水蒸气,防止对E装置反应的影响.故填:吸收水蒸气(或干燥氮气);防止空气中氧气进入E装置;
(2)装置E中氮气与镁反应生成氮化镁,反应方程式为:3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2;故填:3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2;
(3)进行实验时先进行A加热,理由是排尽空气;
故填:A;排尽装置内的空气;
氮化镁与水反应生成氢氧化镁和氨气,根据在化合物中正负化合价代数和为零,则 氮化镁中氮元素的化合价为:(+2)×3+x×2=0,则x=-3,
故答案为:Mg3N2+6H2O═3Mg(OH)2+2NH3↑;-3;
弃去上清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁,反应的方程式:Mg+2HCl═MgCl2+H2↑
故填:Mg+2HCl═MgCl2+H2↑;
(4)解:设样品中氮化镁的质量为X
Mg3N2+6H2O═3Mg(OH)2+2NH3↑
100 34
X 3.4g
$\frac{100}{X}=\frac{34}{3.4g}$
X=10g
Mg3N2的质量分数为$\frac{10g}{16g}$×100%=62.5%
答:样品中氮化镁的质量分数为62.5%.
(5)球形干燥管的作用是充分反应,防倒吸;
故填:充分反应,防止倒吸.
点评 本题以氮化镁的制备为载体,考查学生对实验装置的理解、元素化合物的性质、实验方案的设计等,是对学生综合能力的考查,需要学生基本扎实的基础与分析问题、解决问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 该物质由三种元素组成 | B. | 该物质由10个原子构成 | ||
| C. | 该物质中硅元素的化合价为+6价 | D. | 各元素的质量比为23:27:56:96 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某兴趣小组用10g存放已久的镁条与溶质质量分数为49%的稀硫酸反应,测得产生氢气的质量与稀硫酸的质量关系如图(假设镁条中除表面含有氧化镁外,没有其他杂质)
某兴趣小组用10g存放已久的镁条与溶质质量分数为49%的稀硫酸反应,测得产生氢气的质量与稀硫酸的质量关系如图(假设镁条中除表面含有氧化镁外,没有其他杂质)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 在盐酸、碳酸钠、火碱、二氧化碳、镁、食盐、石灰水、氧化剂、银、木炭粉等物质中,按类别选择适当物质,使如图连线的物质之间能相互反应,并回答问题:
在盐酸、碳酸钠、火碱、二氧化碳、镁、食盐、石灰水、氧化剂、银、木炭粉等物质中,按类别选择适当物质,使如图连线的物质之间能相互反应,并回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com