
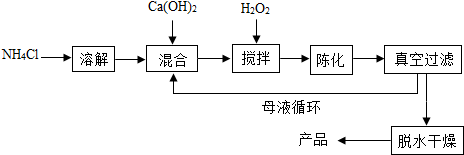
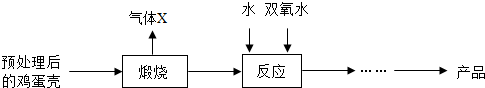
分析 (1)根据质量守恒定律进行分析;
(2)根据鸡蛋壳的主要成分是碳酸钙,碳酸钙在高温的条件下生成氧化钙和二氧化碳,所以X是二氧化碳,在实验室常用氢氧化钠来吸收二氧化碳,氧化钙与水反应生成氢氧化钙,然后依据反应原理、质量守恒定律书写化学方程式,根据实验室控制温度的方法进行分析,根据题中的反应物进行分析;
(3)根据温度过高过氧化物会分解生成氧化物和氧气进行分析;
(4)根据绿色化学的条件进行分析.
解答 解:(1)依据质量守恒定律可知,化学反应前后原子个数不变,所以需要补充的物质是水;
(2)鸡蛋壳的主要成分是碳酸钙,碳酸钙在高温的条件下生成氧化钙和二氧化碳,所以X是二氧化碳,在实验室常用氢氧化钠来吸收二氧化碳,氧化钙与水反应生成氢氧化钙,氢氧化钙和双氧水反应生成过氧化钙晶体,化学方程式为:Ca(OH)2+H2O2+6H2O=CaO2•8H2O,氢氧化钙是反应物,但是在反应过程中不一定会完全反应,所以获得的CaO2产品中主要含有的固体杂质是Ca(OH)2;
(3)依据题中的知识可知,温度过高过氧化物会分解生成氧化物和氧气,所以温度过高会造成氨水挥发外,还能防止过氧化钙分解;
(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,方法2中没有副产物,方法1中有副产物二氧化碳,所以上述两种方法中生成CaO2•8H2O的反应符合“绿色化学”的是:方法2.
故答案为:(1)H2O;
(2)CaO+H2O2+7H2O═CaO2.8H2O,Ca(OH)2;
(3)防止CaO2分解,方法2.
点评 在解此类题时,首先分析题中的反应流程,然后结合学过的知识和题中所给的知识进行分析解答.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:初中化学 来源: 题型:解答题
 目前,我们国家的能源主要依赖于化石燃料,它们属于不可再生能源.因此,开发利用新能源就显得格外重要.
目前,我们国家的能源主要依赖于化石燃料,它们属于不可再生能源.因此,开发利用新能源就显得格外重要.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | FeSO4溶液 Cu Ag | B. | Fe CuSO4溶液 Ag | ||
| C. | Fe Cu AgNO3溶液 稀盐酸 | D. | FeSO4溶液 Cu AgNO3溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
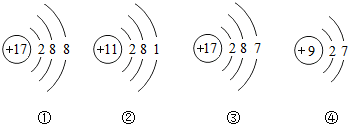
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 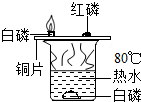 热水的作用是隔绝氧气和提供热量 | |
| B. | 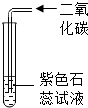 通入二氧化碳后紫色石蕊溶液变红,可证明二氧化碳使紫色石蕊溶液变红 | |
| C. | 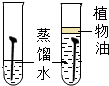 左边试管中铁钉生锈而右边试管中铁钉不生锈,可证明铁生锈是水和氧气的共同作用 | |
| D. | 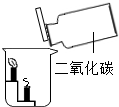 下层蜡烛先熄灭,上层蜡烛后熄灭,证明二氧化碳的密度比空气大且不燃烧,也不支持燃烧 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
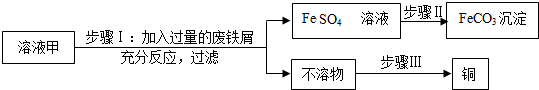
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com