
 某兴趣小组对鸡蛋壳的主要成分和含量进行了探究.
某兴趣小组对鸡蛋壳的主要成分和含量进行了探究.| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入5.00g | 1.50g |
| 第二次加入5.00g | 1.00g |
| 第三次加入5.00g | 0.50g |
| 第四次加入5.00g | 0.30g |
分析 【结论】
根据鸡蛋壳中“加入过量稀盐酸,产生无色无气味的气体,将该气体通入澄清石灰水中,石灰水变浑浊”,则推测该气体通入澄清石灰水中的化学反应方程式;
【解释与交流】根据化学知识“鸡蛋壳和盐酸反应生成的二氧化碳气泡附在鸡蛋壳表面”和物理知识“浮力大于重力,使鸡蛋上浮,鸡蛋到液面后,气泡破灭,重力大于浮力,鸡蛋又下沉”解释鸡蛋上浮、下沉多次的原因.
Ⅱ.(1)根据表格中的实验数据,推测四次实验中,第 四次样品中主要成分已完全反应;
(2)根据碳酸钙的质量和化学方程式,进行金属求鸡蛋壳中主要成分的含量和所用稀盐酸的溶质质量分数;
(3)根据酸碱中和,考虑中和剩余的酸,需要碱的质量,计算所得氯化钙溶液的溶质质量分数.
(4)考虑溶液稀释前后,溶质质量不变.
解答 解:
【结论】
根据鸡蛋壳中“加入过量稀盐酸,产生无色无气味的气体,将该气体通入澄清石灰水中,石灰水变浑浊”,则推测该气体通入澄清石灰水中的化学反应方程式为Ca(OH)2+CO2═CaCO3↓+H2O;
【解释与交流】因为化学知识“鸡蛋壳和盐酸反应生成的二氧化碳气泡附在鸡蛋壳表面”和物理知识“浮力大于重力,使鸡蛋上浮,鸡蛋到液面后,气泡破灭,重力大于浮力,鸡蛋又下沉”,故可解释鸡蛋上浮、下沉多次的原因为:鸡蛋壳和盐酸反应生成的二氧化碳气泡附在鸡蛋壳表面,浮力大于重力,使鸡蛋上浮,鸡蛋到液面后,气泡破灭,重力大于浮力,鸡蛋又下沉.这样反复上下移动.
Ⅱ.(1)根据表格中的实验数据,推测四次实验中,第四次样品中主要成分已完全反应;
(2)鸡蛋壳中碳酸钙的质量为2.00g-0.30g=1.70g,则鸡蛋壳中碳酸钙的含量为$\frac{1.70g}{2.00g}×100%$=85%.
第一次反应消耗碳酸钙的质量为2.00g-1.50g=0.50g,
设第一次反应消耗的稀盐酸的溶质的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73
0.50g x
则$\frac{100}{73}=\frac{0.50g}{x}$,解得x=0.365g
故所用稀盐酸的溶质质量分数为$\frac{0.365g}{5.00g}$×100%=7.3%;
(3)因为鸡蛋壳中碳酸钙的质量为2.00g-0.30g=1.70g,则设消耗氯化氢的质量为x,生成二氧化碳的质量为y,生成氯化钙的质量为z.
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73 111 44
1.70g x z y
则$\frac{100}{73}=\frac{1.70g}{x}$,$\frac{100}{44}=\frac{1.70g}{y}$,$\frac{100}{111}=\frac{1.70g}{z}$,解得x=1.24g,y=0.748g,z=1.887g
故剩余氯化氢的质量为20.00g×7.3%-1.24g=0.22g,生成二氧化碳的质量为0.748g,生成氯化钙的质量为1.887g.
设中和0.22g氯化氢,需要氢氧化钙的质量为y,生成生成氯化钙的质量为n.
Ca(OH)2+2HCl═CaCl2+2H2O,
74 73 111
y 0.22g n
则$\frac{74}{73}=\frac{y}{0.22g}$,$\frac{73}{111}=\frac{0.22g}{n}$,解得y≈0.22g,n≈0.335g
则所得氯化钙溶液的溶质质量分数$\frac{1.887g+0.335g}{20.00g+1.70g+30.00g+0.22g-0.748g}$×100%≈4.4%.
(4)设需要36.5%的浓盐酸的质量为w,
则w×36.5%=7.3%×20.00g,解得w=4g,
用36.5%的浓盐酸配制20.00g上述稀盐酸需加水的质量为:20.00g-4g=16g,故需加水的体积为16.0mL.
故答案为:
【结论】Ca(OH)2+CO2═CaCO3↓+H2O
实验二:【解释与交流】鸡蛋壳和盐酸反应生成的二氧化碳气泡附在鸡蛋壳表面,浮力大于重力,使鸡蛋上浮,鸡蛋到液面后,气泡破灭,重力大于浮力,鸡蛋又下沉.这样反复上下移动
(1)四;(2)7.3%;(3)0.22;4.4%;(4)16.0mL
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


科目:初中化学 来源: 题型:多选题
| 选项 | 物质 | 杂质 | 除杂方法 |
| A | CO2 | 水蒸气 | 通入浓硫酸中 |
| B | FeSO4溶液 | CuSO4 | 加入过量的铁粉,过滤 |
| C | 铁粉 | 铜粉 | 加入足量的稀硫酸,过滤 |
| D | CaO | CaCO3 | 加入水,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 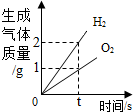 水的电解 | |
| B. | 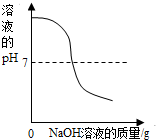 向稀盐酸中滴加过量的氢氧化钠溶液 | |
| C. | 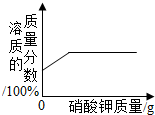 在某温度下,向一定质量的硝酸钾饱和溶液中不断加入硝酸钾晶体 | |
| D. |  等质量的锌、铁分别与足量等溶质质量分数的稀硫酸反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 连接玻璃管和胶皮管时,先用水润湿管口 | |
| B. | 用嘴吹熄酒精灯 | |
| C. | 浓硫酸沾到皮肤上先用水冲洗,再涂上氢氧化钠溶液 | |
| D. | 一氧化碳还原氧化铁时,应先加热后再通入一氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 汽车、电动车一般使用铅酸蓄电池.某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸.
汽车、电动车一般使用铅酸蓄电池.某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com