
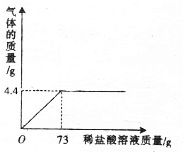
 某兴趣小组为测定某混合物(碳酸钙和氯化钙)中碳酸钙的含量,取该混合物11.11g于烧杯中,向其中加入足量的稀盐酸,实验过程中,收集到的二氧化碳与反应时间关系如图所示(假设气体全部逸出).计算:
某兴趣小组为测定某混合物(碳酸钙和氯化钙)中碳酸钙的含量,取该混合物11.11g于烧杯中,向其中加入足量的稀盐酸,实验过程中,收集到的二氧化碳与反应时间关系如图所示(假设气体全部逸出).计算:分析 根据图示可得二氧化碳的质量,结合碳酸钙与盐酸反应的方程式,可以计算碳酸钙和氯化氢的质量以及生成氯化钙的质量,进一步计算所加稀盐酸的质量分数.根据质量守恒定律计算烧杯中钙元素的质量.
解答 解:(1)根据图示可得二氧化碳的质量为4.4g
设样品中CaCO3质量为x,反应的氯化氢质量为y,生成氯化钙的质量为z,
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73 111 44
x y z 4.4g
$\frac{100}{x}=\frac{73}{y}=\frac{111}{z}=\frac{44}{4.4g}$
x=10g,y=7.3g,z=11.1g
(2)所加稀盐酸的质量分数为$\frac{7.3g}{73g}$×100%=10%,
(3)由质量守恒定律可知,钙元素反应前后的质量不变,始终在烧杯中,所以钙元素的质量可以安反应后计算,反应后氯化钙为:11.1g+(11.11g-10g)=12.21g,钙元素的质量为:12.21g×$\frac{40}{111}$×100%=4.4g,所以加入36.5g稀盐酸时,烧杯中钙元素的质量也为4.4g.
答:(1)所取混合物中碳酸钙的质量为10g.
(2)所加稀盐酸的质量分数为10%.
(3)加入36.5g稀盐酸时,烧杯中钙元素的质量为4.4g.
点评 本题主要考查学生运用化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
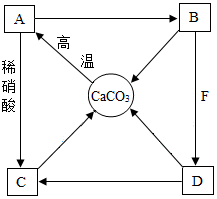 A~F是初中化学常见物质,A、B、C、D和CaCO3均含有同一种元素,其中B常用于改良酸性土壤,胃液中含有F.它们之间的转化关系如图所示,“→”表示相互转化.请回答:
A~F是初中化学常见物质,A、B、C、D和CaCO3均含有同一种元素,其中B常用于改良酸性土壤,胃液中含有F.它们之间的转化关系如图所示,“→”表示相互转化.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH、BaCl2、MgSO4、HCl | B. | NaOH、NaCl、稀HCl、FeCl3 | ||
| C. | AgNO3、稀HCl、FeCl3、NaNO3 | D. | Na2SO4、NaOH、BaCl2、CuCl2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 青蒿素由三种原子构成 | |
| B. | 青蒿素属于有机高分子化合物 | |
| C. | 青蒿素中碳元素和氧元素的质量比为3:1 | |
| D. | 青蒿素的相对分子质量为282 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验方案 | 实验操作 | 实验现象 | 实验结论 |
| 方案一 | 取适量反应后的溶液于试管中,滴加几滴无色的酚酞试液,振荡 | 溶液变红色 | 猜想①正确 |
| 方案二 | 用一根洁净的玻璃棒蘸取反应后的溶液滴在pH试纸上,把试纸呈现的颜色与标准比色卡对照 | pH=7 | 猜想②正确 |
| 方案三 | 取适量锌粒于试管中,加入适量反应后的溶液 | 有气泡产生 | 猜想③正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com