
硫酸是柳州市的一种重要工业产品,下图是工业采用接触法生产硫酸的工艺流程图
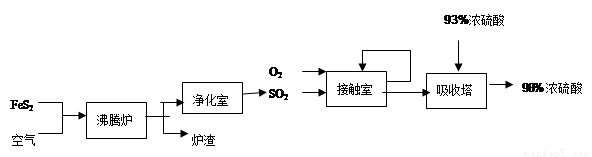 (1)从硫酸厂的生产流程中不难发现,吸收塔中SO2不可能是100%吸收,所以尾气必须处理,否则含大量SO2的尾气会造成环境的污染,最大的危害是形成 ;为了减少这种污染,对此生产流程可采取的措施是 (选填下列做法的序号)。
(1)从硫酸厂的生产流程中不难发现,吸收塔中SO2不可能是100%吸收,所以尾气必须处理,否则含大量SO2的尾气会造成环境的污染,最大的危害是形成 ;为了减少这种污染,对此生产流程可采取的措施是 (选填下列做法的序号)。
①杜绝用煤做燃料;②把工厂的烟囱加高;③用烧碱溶液吸收后再排放;
④开发新能源; ⑤研究经济高效的回收SO 2的技术。
(2)沸腾炉中发生的主要反应是4FeS2+11O2高温2R +8SO2,推断炉渣的主要成分R的化学式是
(3)为了提高硫铁矿(主要成份是FeS2)的利用率,在工业生产中,需要将硫铁矿粉碎后再进行生产的原因是什么?
(4)写出接触室发生的反应的化学方程式并指出其所属的基本反应类型(3分)
(5)为了提高硫酸的利用率,吸收塔选用93%的浓硫酸来吸收,写出吸收塔内发生的反应的化学方程式
(6)若将100g质量分数为98%的浓硫酸稀释为10%的稀硫酸需加水 g。
(7)浓硫酸具有强烈腐蚀性,生产时每个工人必须严格按照规程进行操作,如果不慎将少量的浓硫酸沾到皮肤或衣服上,你的处理方法是什么?
(1)酸雨;③⑤(2分,答出一点给一分,多答不给分)(2)Fe2O3 (3)增大硫铁矿与氧气的接触面,使反应更充分
(4)2SO2 + O2 ="=" 2SO3 化合反应 (5)SO3 + H2O ="==" H2SO4(6)880
(7)先用大量水冲洗,再涂上3%-5%的碳酸氢钠溶液
【解析】
试题分析:(1)二氧化硫增多会形成酸雨,可以用烧碱溶液吸收后再排放,或者研究经济高效的回收SO 2的技术;(2)根据质量守恒定律,化学反应前后原子种类、数目均不发生变化,则R的化学式为Fe2O3;(3)粉碎后可以增大与氧气的接触面积使燃烧更加充分;(4)接触室是二氧化硫和氧气反应生成三氧化硫的过程,为化合反应;(5)吸收塔内是三氧化硫和水反应生成硫酸的过程;(6)设需加水的质量为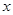 。
。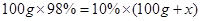 ,解得
,解得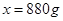 ;(7)浓硫酸有强烈的腐蚀性,若滴到身体上应先用大量水冲洗,再涂上3%-5%的碳酸氢钠溶液。
;(7)浓硫酸有强烈的腐蚀性,若滴到身体上应先用大量水冲洗,再涂上3%-5%的碳酸氢钠溶液。
考点:硫酸的生产
点评:此题考察知识点较为陌生,但仔细审题可知考察的思想和基本知识点都是中考要求的基本知识,此题有一定的难度,要多读提,多联系题干。


科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源:2013届广西柳州市九年级第二次教学质量检测化学试卷(带解析) 题型:填空题
硫酸是柳州市的一种重要工业产品,下图是工业采用接触法生产硫酸的工艺流程图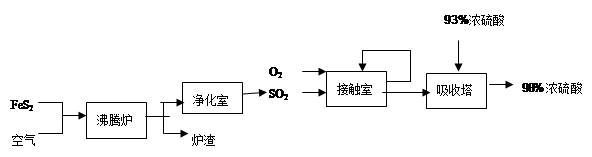 (1)从硫酸厂的生产流程中不难发现,吸收塔中SO2不可能是100%吸收,所以尾气必须处理,否则含大量SO2的尾气会造成环境的污染,最大的危害是形成 ;为了减少这种污染,对此生产流程可采取的措施是 (选填下列做法的序号)。
(1)从硫酸厂的生产流程中不难发现,吸收塔中SO2不可能是100%吸收,所以尾气必须处理,否则含大量SO2的尾气会造成环境的污染,最大的危害是形成 ;为了减少这种污染,对此生产流程可采取的措施是 (选填下列做法的序号)。
①杜绝用煤做燃料;②把工厂的烟囱加高;③用烧碱溶液吸收后再排放;
④开发新能源; ⑤研究经济高效的回收SO 2的技术。
(2)沸腾炉中发生的主要反应是4FeS2+11O2高温2R +8SO2,推断炉渣的主要成分R的化学式是
(3)为了提高硫铁矿(主要成份是FeS2)的利用率,在工业生产中,需要将硫铁矿粉碎后再进行生产的原因是什么?
(4)写出接触室发生的反应的化学方程式并指出其所属的基本反应类型(3分)
(5)为了提高硫酸的利用率,吸收塔选用93%的浓硫酸来吸收,写出吸收塔内发生的反应的化学方程式
(6)若将100g质量分数为98%的浓硫酸稀释为10%的稀硫酸需加水 g。
(7)浓硫酸具有强烈腐蚀性,生产时每个工人必须严格按照规程进行操作,如果不慎将少量的浓硫酸沾到皮肤或衣服上,你的处理方法是什么?
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源:2013年广西柳州市中考化学二模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com