
【题目】下图中的A~F是初中化学实验中常用的几种装置,按要求回答问题。

(1)写出仪器a的名称:_____。
(2)若实验室用高锰酸钾制取氧气,应选用的发生装置为_____,该反应的化学方程式为_____。
(3)若实验室用大理石和稀盐酸制取并收集二氧化碳,应选用的装置为_____,该反应的化学方程式为_____。把生成的气体从_____(填“b”或“e”)通入F装置,可得到干燥的二氧化碳气体。
(4)往试管里装入固体粉末时,可先使试管倾斜,把盛有药品的药匙小心地送至试管_____(“上部”、“中部”或“底部”),然后使试管直立起来。
【答案】长颈漏斗 A ![]() BC
BC ![]() b 底部
b 底部
【解析】
(1)由图可知仪器a是长颈漏斗:故填:长颈漏斗
(2)实验室用高锰酸钾制取氧气的反应物是固体,反应条件是加热,实验室用高锰酸钾制取氧气,可选用的发生装置为A,高锰酸钾加热分解生成氧气,化学方程式为:2KMnO4![]() K2MnO4+ MnO2+O2
K2MnO4+ MnO2+O2![]() ;故填:A;2KMnO4
;故填:A;2KMnO4![]() K2MnO4+ MnO2+O2
K2MnO4+ MnO2+O2![]()
(3)实验室制取二氧化碳的反应物是固体和液体,反应条件是常温,二氧化碳的密度比空气大,溶于水,所以用大理石和稀盐酸制取并收集二氧化碳,可选用的发生及收集装置是BC,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl==CaCl2 +H2O+ CO2![]() ;把生成的气体通入浓硫酸干燥时,应该长进短出,让气体与浓硫酸充分接触,从b通入F装置,可得到干燥的二氧化碳气体。故填:BC;CaCO3+2HCl==CaCl2 +H2O+ CO2
;把生成的气体通入浓硫酸干燥时,应该长进短出,让气体与浓硫酸充分接触,从b通入F装置,可得到干燥的二氧化碳气体。故填:BC;CaCO3+2HCl==CaCl2 +H2O+ CO2![]() ;b
;b
(4)往试管里装入固体粉末时,可先使试管倾斜,把盛有药品的药匙小心地送至试管底部,然后使试管直立起来,防止固体粉末附在试管壁上。故填:底部


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:初中化学 来源: 题型:
【题目】对空气中氧气含量测定的再认识。
Ⅰ用燃烧法测定空气中氧气含量
【实验回顾】图1是实验室用红磷燃烧来粗略测定空气中氧气含量的装置。

(1) 写出红磷燃烧的文字表达式_______________。
(2) 实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内___________减小,烧杯中水倒吸到集气瓶中。用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量。
【实验过程】
甲小组同学使用图1装置进行实验,实验前应先进行的操作是 ;
(1)用止水夹夹紧橡皮管;
(2)点燃燃烧匙内的红磷,立即伸入瓶中并塞紧瓶塞;
(3)燃烧结束,_______________________;
(4)观察并记录水面的变化情况。
【问题提出】该小组同学多次实验发现,集气瓶内上升的水面始终小于理论值。经查阅资料知:燃烧过程中当氧气体积分数低于7% 时,红磷就无法继续燃烧,因此通过上述实验,测置结果与理论值误差较大。
Ⅱ 改进空气中氧气含量测定的方法
【实验改进】经查阅资料可知:常温下,铁在潮湿的空气中会生锈,因为铁与空气中的氧气、少量水反应生成铁锈(其主要成分是Fe2O3),但速度缓慢。在有食盐(NaCl)、活性炭存在条件下,反应速度较快。乙小组选择该原理,设计了如图2所示实验装置图。

【数据处理】乙小组同学用量筒测量实验前后烧杯中水的体积,测得实验数据如下表:

根据表中数据计算,改进实验后测得的空气中氧气的体积分数是___________(计算结果精确到0.1%)。
【实验反思】与燃烧红磷方法相比,乙小组方法测定空气中氧气含量的优点是___________________________。
【实验再改进】在乙组实验的基础上,丙组同学设计了如图3的装置进行氧气含量的测定,其方法如下:
【实验过程】
步骤1:在注射器中放入足量脱氧剂粉末(即食盐水、铁粉、活性炭的混合物,体积为2mL),封闭。

图3
步骤2:打开弹簧夹,将活塞向右拉至一定距离,关闭弹簧夹。
步骤3:不断轻轻晃动注射器,至______________时停止实验。
【实验再反思】
丙小组同学的方案与乙小组的方案同学相比,优点是_________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下图回答相关问题:

(1)写出两种仪器的名称;a_________,d_________.
(2)收集干燥的![]() 气体,可选用_________(填“C”或“D”)戴置;若改用G、H和I这个组合装置收集,H装置的作用是__________________。
气体,可选用_________(填“C”或“D”)戴置;若改用G、H和I这个组合装置收集,H装置的作用是__________________。
(3)制氢气时,用B装置代替A装置的优点是__________________;若用E装置收集氢气,气体应从_________(填“b”或“c”)端进入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有含杂质的硝酸钠溶液,为确定其组成,某同学设计了如下实验:
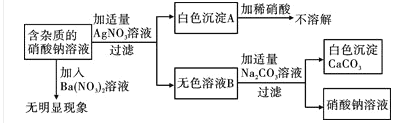
下列判断正确的是
A. 无色溶液B的溶质是硝酸钙
B. 原溶液中的杂质一定是氯化钙
C. 原溶液中的杂质可能由三种物质组成
D. 该实验中涉及的基本反应类型不止一种
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一瓶存放很久的生石灰,小轩同学想了解其变质情况,设计如下实验:
(实验1):取少量样品于烧杯中,加入一定量水,触摸烧杯外壁,感觉发热。充分 搅拌后过滤,得到白色沉淀和无色滤液。小轩同学对样品的组成提出了以下假设:
假设1.是Ca(OH)2和CaCO3的混合物,
假设2.是CaO和CaCO3的混合物,
假设3.是CaO和Ca(OH)2的混合物,
假设4.是CaO、Ca(OH)2、CaCO3的混合物。
(1)通过实验现象可以直接看出,其中假设____________不合理。
(2)为了判断其他几种假设的合理性,他继续进行实验:
(实验2):取少量沉淀放在试管中,加入足量稀盐酸,产生气泡,由此可否定假设____________。
(实验3):取少量滤液放在另一支试管中,加入碳酸钠溶液后溶液变浑浊,反应的化学方程式为:____________,于是小轩同学得到结论:只有假设4合理。但你认为此实验仍不能得到最后结论,请说明原因:____________。
(3)为了得到最后结论,小轩在老师的指导下设计了如下实验:
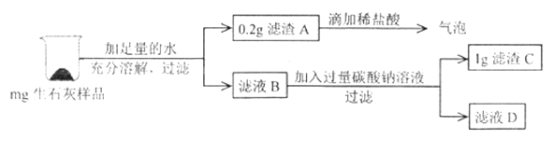
向滤液D中逐滴加入过量稀盐酸,观察到的现象是________________________;
通过上述实验,小轩最终得出假设4成立,请根据所给实验数据进行计算,推测他所称取的生石灰样品的质量范围是________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有失去标签的五个试剂瓶,分别盛有NaOH溶液、CuSO4溶液、BaCl2溶液、稀盐酸和稀硫酸。鉴别操作如下:
(1)呈蓝色的溶液为CuSO4溶液。取少量其他溶液分别于四支试管中,再分别滴加CuSO4溶液,可鉴别出NaOH溶液和BaCl2溶液。鉴别出NaOH溶液的现象是_____。
(2)另取少量剩余的两种溶液分别放入两支试管中,再分别滴加BaCl2溶液,其中一支试管内产生白色沉淀,该反应的化学方程式为_____。
(3)实验结束后,将所有试管中的物质充分混合,过滤除去沉淀,得到无色滤液,此滤液一定含有的溶质为_____(填化学式)。取少量无色滤液滴加Na2SO4溶液,无明显现象。另取少量无色滤液分别与下列物质混合时,一定无明显现象的是_____。
A Ba(OH)2溶液 B AgNO3溶液 C Mg D 酚酞溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验中经常用到一定溶质质量分数的溶液。请回答:
(1)实验室配制质量分数![]() 的氯化钠溶液
的氯化钠溶液![]() 。需要固体氯化钠的质量为_____g,水为_____mL(水的密度
。需要固体氯化钠的质量为_____g,水为_____mL(水的密度![]() )。
)。
(2)若用质量分数为![]() 的氯化钠溶液配制
的氯化钠溶液配制![]() 质量分数为
质量分数为![]() 的氯化钠溶液。
的氯化钠溶液。
①需要![]() 的氯化钠溶液的质量为_____g。
的氯化钠溶液的质量为_____g。
②该溶液配制过程中除用到量筒、玻璃棒和胶头滴管外,还需要的仪器是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硅酸钠(Na2SiO3)是我国优先发展的精细化工产品。实验室以5g石英砂粉末(其中SiO2质量分数为96%,其余为不溶于水也不与其他物质反应的杂质)为原料,与一定量NaOH溶液反应制取硅酸钠溶液,反应的方程式为:2NaOH+SiO2=Na2SiO3+H2O。充分反应后,过滤,得到硅酸钠溶液20g,滤渣洗涤、烘干,称量质量为2g。
(1)硅酸钠中钠元素、硅元素、氧元素的质量比为_____;
(2)若把20g硅酸钠溶液,稀释为质量分数为10%的溶液,求需要加入水的质量;_____
(3)求原氢氧化钠溶液中溶质的质量分数。_____(计算结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在人类社会的发展进程中,金属起着重要的作用。根据所学知识回答:
(1)合金是在金属中_____某些金属或非金属,制得的具有金属特征的材料。
(2)生铁和钢是两种含碳量不同的铁合金,其中钢的含碳量为_____。
(3)金属的热处理有两种方法,其中一种热处理,能使钢材的硬度和耐磨性增强,塑性和韧性降低。这种热处理方法是_____(填“淬火”或“回火”)。
(4)向氧化铜和铁粉的混合物中加入一定量稀硫酸,反应停止后,过滤,向滤渣中再滴加稀硫酸,没有任何现象,则滤渣中一定含有_____(填化学式)。
(5)冶炼含四氧化三铁![]() 的磁铁矿石
的磁铁矿石![]() ,理论上能得到含杂质
,理论上能得到含杂质![]() 的生铁的质量是_____
的生铁的质量是_____![]() (结果精确到
(结果精确到![]() )。
)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com