
| 序号 | 实验过程 | 实验现象 | 本实验得出的结论 | 可能的一般规律 |
| 1 | 镁粉和铁粉分别与5%盐酸反应 | 镁粉产生气体快 | 反应物的本性决定化学反应速度 | |
| 2 | 铁粉和铁片分别与10%盐酸反应 | 铁粉产生气体快 | ||
| 3 | 铁片分别与5%盐酸和10%盐酸反应 | 10%盐酸产生气体快 | 盐酸浓度越大反应速度越快 |
分析 本题是对影响金属与酸反应的剧烈程度不同的因素的探究,利用了控制变量法,即其它量保持不变,控制一个变量.
实验1是研究反应的剧烈程度与金属活动性有关,取用的是镁片和铁片,然后由现象得出正确的结论;
实验2是研究反应剧烈程度与金属表面积大小有关,其它条件不变,取用的是铁粉和铁片,铁粉比较快;
实验3是研究反应剧烈程度与酸的浓度有关,其它条件不变,取用的是不同浓度盐酸溶液,浓度大的比较快.
解答 解:1、镁粉产生气体的速度快,说明金属活动性越强,反应速率越快;
2、铁粉与盐酸的接触面积比铁片与酸的接触面积大,而铁粉的产生气体快,说明金属与酸反应的速率与金属和酸的接触面积有关,即接触面积越大反应越快;
3、铁片分别与5%盐酸和10%盐酸反应,10%盐酸产生气体快,说明金属与酸反应的速率是否与酸的浓度有关,即浓度越大反应速率越快.
故答案为:
| 序号 | 实验过程 | 实验现象 | 本实验得出的结论 | 可能的一般规律 |
| 1 | 镁粉和铁粉分别与5%盐酸反应 | 镁粉产生气体快 | 金属活动性越强反应越快 | 反应物的本性决定化学反应速度 |
| 2 | 铁粉和铁片分别与10%盐酸反应 | 铁粉产生气体快 | 接触面积越大反应越快 | 反应物的接触面积决定化学反应速度 |
| 3 | 铁片分别与5%盐酸和10%盐酸反应 | 10%盐酸产生气体快 | 盐酸浓度越大反应速度越快 | 反应物的浓度决定化学反应速度 |
点评 本题是对影响金属与酸反应的剧烈程度不同的因素的探究,分析时要注意从金属的活动性、金属的状态和酸的浓度等不同的角度进行探究,利用了控制变量法,即其它量保持不变,来探究某一个量对反应的影响.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
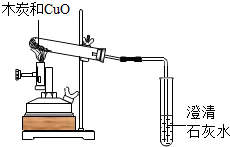 我国劳动人民早在五千年前就会使用木炭炼铜.化学兴趣小组采用如图装置,开展以下探究活动
我国劳动人民早在五千年前就会使用木炭炼铜.化学兴趣小组采用如图装置,开展以下探究活动| 步骤 | 现象 | 结论 |
| ①取1.44g红色固体装入试管,滴入足量的稀硫酸,充分反应 | 红色固体部分减少,溶液变为蓝色 | 猜想①错误 |
| ②过滤出试管中残留的红色固体,洗涤干燥,称其质量为1.04g | 猜想③正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com