
| A. | YX | B. | Y2X | C. | YX2 | D. | XY |
分析 X元素原子的最外层有6个电子,Y元素的原子最外层有2个电子,由化合价的数值等于离子所带电荷的数值且符号一致,确定出X、Y元素的化合价,进而由化合物化学式的书写方法进行解答即可.
解答 解:X元素原子的最外层有6个电子,在化学反应中易得到2个电子而形成带2个单位负电荷的阴离子;Y元素的原子最外层有2个电子,在化学反应中易失去2个电子而形成带2个单位正电荷的阳离子;化合价的数值等于离子所带电荷的数值,且符号一致,则X元素的化合价为-2价,Y元素的化合价为+2价,则由X、Y两种元素形成的化合物的化学式为YX.
故选:A.
点评 本题难度不大,掌握化合价的数值等于离子所带电荷的数值且符号一致、化合物化学式的书写方法是正确解答本题的关键.


科目:初中化学 来源: 题型:选择题
| A. | 生活中和工业上用的盐通常都为NaCl | |
| B. | 电解水时,为了增强溶液的导电性,可以加入NaCl | |
| C. | 我们获得NaCl的主要来源是用烧碱和盐酸反应制得 | |
| D. | 鉴别NaCl溶液和Na2CO3溶液可以用酚酞试剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 温度(℃) | 0 | 20 | 40 | 60 | 80 |
| 溶解度(g) | 13.3 | 31.6 | 63.9 | 110 | 169 |
| A. | KNO3的溶解度随温度的上升而变大 | |
| B. | 20℃时,100g饱和KNO3溶液中含有31.6gKNO3 | |
| C. | 将40℃的KNO3饱和溶液升温至60℃,该溶液变成不饱和溶液 | |
| D. | 将80℃的KNO3饱和溶液降温至20℃,有晶体析出 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
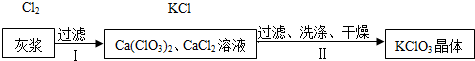
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤及操作 | 实验现象 | 结论 |
| ①取部分该样品于试管中,加少量水 | 无明显放热现象 | 碱石灰样品中不含CaO和NaOH |
| ②继续加足量水,振荡, ③过滤,向白色沉淀中滴加稀盐酸 | 产生白色沉淀 白色沉淀消失,并产生气泡 | 碱石灰样品中一定含有CaCO3 |
| ④从步骤②的试管中取少量上层清液于另一试管中, 向其中滴加过量BaCl2溶液 | 产生白色沉淀 |  |
| ⑤从步骤④的试管中取上层清液于另一试管中, 向其中滴加无色酚酞试液 | 溶液变红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氮气、氧气、空气 | B. | 冰、干冰、食醋 | ||
| C. | 白磷、水、大理石 | D. | 硫磺、氯酸钾、5%的过氧化氢溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
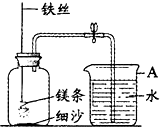 某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶容积的70%.
某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶容积的70%.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com