
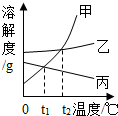
 如图为甲、乙、丙三种固体物质在水中的溶解度曲线,请回答
如图为甲、乙、丙三种固体物质在水中的溶解度曲线,请回答科目:初中化学 来源: 题型:实验探究题
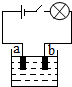 小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:
小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:| 物质 导电性 状态 | 食盐NaCl | 硝酸钾KNO3 | 蔗糖C12H22O18 | 氢氧化钠NaOH | 硫酸铜CuSO4 |
| 固态 | × | × | × | × | × |
| 熔化状态 | √ | √ | × | √ | √ |
| 水溶液 | √ | √ | × | √ | √ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | B. | CO2+H2O═H2CO3 | ||
| C. | 3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4 | D. | Ca(HCO3)2═CaCO3+CO2↑+H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 方案 | 加入试剂 | 分离方法 | 方案评价 |
| 1 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | 不可行,理由是引入了新杂质硝酸钠 |
| 2 | 过量的稀盐酸 | 蒸发结晶 | 可行 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硬水中含有较多的钙、镁物质,用硬水洗衣服会浪费肥皂 | |
| B. | 工业酒精对人体有害,不能用于调饮用酒 | |
| C. | 发现煤气泄漏,应立即打开排气扇电源开关排气 | |
| D. | 进入久未开启的菜窖、干涸的深井和深洞前,要做灯火试验 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 二氧化锰没有参与化学反应 | B. | 与高锰酸钾制取氧气装置相同 | ||
| C. | 可用向上排空气法收集 | D. | 可用带火星的木炭检验氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
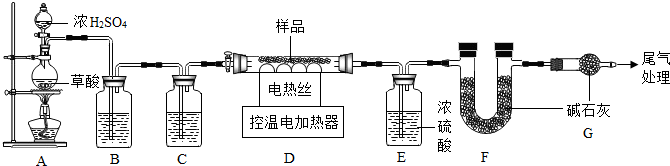
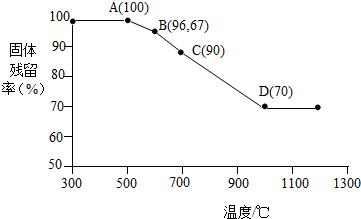
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com