
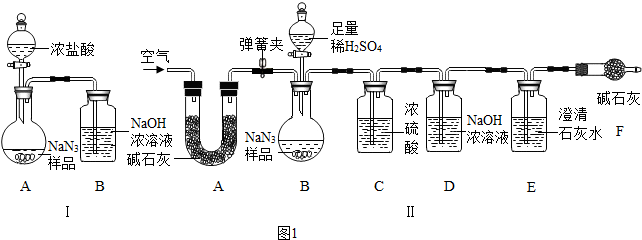
分析 (1)根据质量守恒定律的实质来判断X的化学式,再根据气体的酸碱性考虑检验方法;
(2)根据氢氧化钠溶液可以和二氧化碳反应的性质来完成解答;
(3)①浓盐酸易挥发,产生的氯化氢气体,进入B装置;
②根据碱石灰、浓硫酸、澄清石灰水的成分和用途回答;
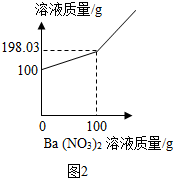
③根据碳酸钠能够和硝酸钡反应生成沉淀设计实验验证反应的程度;根据坐标结合质量守恒定律计算沉淀的质量,依据方程式计算碳酸钠及碳酸钠的质量分数.
解答 解(1)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X的化学式为:NH3,氨气溶于水形成的氨水显碱性,能使湿润的红色石蕊试纸变蓝,使无色酚酞试液变红色,所以可以用无色酚酞试纸或红色石蕊试纸检测;
故答案为:NH3;用湿润的红色石蕊试纸观察现象(或通入滴有无色酚酞的水中,观察现象);
(2)制备工业级NaN3时同时生成氢氧化钠,它能和空气中的二氧化碳反应生成Na2CO3.
故答案为:2NaOH+CO2═Na2CO3+H2O;
(3)要测定某工业级NaN3样品中含有Na2CO3的质量分数,根据NaN3遇盐酸、H2SO4溶液无气体生成,而Na2CO3遇盐酸、H2SO4溶液生成CO2气体,由CO2的质量可以求出Na2CO3的质量,进而求出Na2CO3的质量分数;
①装置 I用浓盐酸与样品反应,浓盐酸具有挥发性,产生的氯化氢气体被装置B吸收,二氧化碳气体逸出时带出的水蒸气在装置B中冷凝而被吸收;装置A、B内空气中的二氧化碳被装置B吸收;A中生成的二氧化碳不能全部进入B装置,使实验产生误差等;
故答案为:二氧化碳中混有浓盐酸挥发的氯化氢气体(或二氧化碳气体中混有水蒸气等合理即可);
②装置II中A中药品是碱石灰,碱石灰可作干燥剂,能吸收空气中的水分和二氧化碳,防止空气中水蒸汽和二氧化碳干扰试验;C装置的浓硫酸干燥CO2气体,若无C装置会使实验结果偏大;CO2通入澄清石灰水,使澄清石灰水变浑浊,装置E的作用是检验二氧化碳是否被D装置完全吸收,防止空气中的二氧化碳和水蒸气进入D装置;
故答案为:吸收空气中的水和二氧化碳;偏大;检验二氧化碳已被吸尽;
③因为碳酸钠能够和硝酸钡反应产生碳酸钡沉淀,因此可以取上层清液继续滴加Ba(NO3)2溶液,若有白色沉淀,说明不足量,若没有白色沉淀,说明已足量;
ⅰ.根据坐标及质量守恒定律可知,产生沉淀的质量为:100g+100g-198.03g=1.97g;
ⅱ.根据化学方程式中碳酸钡的质量计算碳酸钠的质量,再计算碳酸钠的质量分数.
故答案为:取上层清液继续滴加Ba(NO3)2溶液,若有白色沉淀,说明不足量,若没有白色沉淀,说明已足量;
ⅰ.1.97;
ⅱ.设样品中Na2CO3的质量为x.
Na2CO3+Ba(NO3)2═2NaNO3+BaCO3↓
106 197
x 1.97g
$\frac{106}{x}$=$\frac{197}{1.97g}$ x=1.06g
该样品中Na2CO3的质量分数为:$\frac{1.06g}{20g}$×100%=5.3%
答:该样品中Na2CO3的质量分数为5.3%.
点评 本题属于信息题的考查,综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练.


科目:初中化学 来源: 题型:选择题
| A. | 篮球架的表面喷涂油漆,只是为了美观 | |
| B. | 不锈钢抗腐蚀性好,常用于制医疗器械,炊具等 | |
| C. | 回收金属饮料罐,只是为了减少环境污染 | |
| D. | 银的导电性比铜好,所以常用银作电线而不用铜 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | ④ | B. | ③④ | C. | ①④ | D. | ②③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaF+H2O═NaOH+HF | B. | C+H2O(气态)$\frac{\underline{\;高温\;}}{\;}$CO+H2 | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | CaO2+2H2O═Ca(OH)2+H2O2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 向NaOH固体中加入稀盐酸 | 液体温度升高 | 说明该反应放热 |
| B | 向黑色粉末中加入某无色溶液 | 产生大量气泡 | 黑色粉末一定是铁粉 |
| C | 向饱和石灰水中加入某物质 | 溶液变浑浊 | 某物质一定是氧化钙 |
| D | 将一半用水润湿的紫色石蕊小花放入充满CO2的广口瓶中 | 紫色石蕊小花干的一半不变红,湿的一半变红 | CO2与H2O发生了化学反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com