

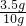 ×100%=35%
×100%=35%

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| 方案 | 实验操作 | 预期的实验现象 | 相应结论 |
| ① | ② | 猜想①成立 | |
| ③ | ④ | 猜想②成立 |
查看答案和解析>>
科目:初中化学 来源:点试成金·化学·中考考点大突破 题型:058
实验课上,老师把一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液.老师让同学们对滤液的组成进行探究.
(1)同学们对滤液中所含的溶质做出了多种猜想,其中有两种猜想可能成立,这两种猜想是:
①溶质为_____________;②溶质为_____________.
(2)请你设计实验来验证这两种猜想.
查看答案和解析>>
科目:初中化学 来源:2006年辽宁省锦州市中考化学试题 题型:059
实验课上,老师把一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液.老师让同学们对滤液的组成进行探究.
(1)同学们对滤液中所含的溶质做出了多种猜想,其中有两种猜想可能成立,这两种猜想是:
①溶质为________;
②溶质为________.
(2)请你设计实验来验证这两种猜想.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com