

 ”和“
”和“ ”分别表示不同的原子).
”分别表示不同的原子).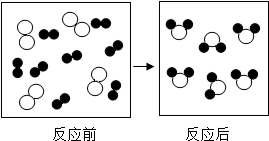
 ”微粒.
”微粒.| 物质 | A | B | C | D |  |
| 微观示意图 |  |
 |
 |
||
| 反应前质量/g | 100 | 1 | 1 | 46 | |
| 反应后质量/g | 4 | 89 | 55 | x |
| ||
| ||
 粒子各原子个数正好相等,从图示可以看出化学变化的实质是:分子的分开原子的重新组合.
粒子各原子个数正好相等,从图示可以看出化学变化的实质是:分子的分开原子的重新组合.| 16×2 |
| 44 |
| 16 |
| 18 |
88g×
| ||
| 12 |
54g×
| ||
| 1 |
| 112g-96g |
| 16 |
| ||
| ||


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:初中化学 来源: 题型:
 (2012?塘沽区二模)质量守恒定律对科学发展具有重大意义.
(2012?塘沽区二模)质量守恒定律对科学发展具有重大意义. ”和“
”和“ ”分别表示不同的原子)
”分别表示不同的原子) ”微粒.
”微粒.| 物质 | A | B | C | D |  |
微观示意图 |
 |
 |
 |
||
| 反应前质量/g | 100 | 1 | 1 | 46 | |
| 反应后质量/g | 4 | 89 | 55 | X |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:2011-2012学年天津市塘沽区初三第二学期质量检测化学试卷(二)(带解析) 题型:填空题
(6分)质量守恒定律对科学发展具有重大意义。
(1)由质量守恒定律可知,化学反应前后一定不变的是 (填序号)。
①原子种类 ②原子数目 ③分子种类
④分子数目 ⑤元素种类 ⑥物质种类
(2)下图是某反应的微观示意图(其中“ ”和“
”和“ ”分别表示不同的原子)。
”分别表示不同的原子)。
①反应后方框内应再填入 个“ ”微粒。
”微粒。
②请从微观的角度分析化学变化的实质是 。
(3)在一密闭容器内有4种物质A、B、C、D,它们在一定条件下发生化学反应。其中A、B、C的微观示意图和反应前后各物质的质量如下表所示。
①x的值为 。
②若D的相对分子质量为46,该反应的化学方程式是 。
查看答案和解析>>
科目:初中化学 来源:2012届天津市塘沽区初三第二学期质量检测化学试卷(二)(解析版) 题型:填空题
(6分)质量守恒定律对科学发展具有重大意义。
(1)由质量守恒定律可知,化学反应前后一定不变的是 (填序号)。
① 原子种类 ② 原子数目 ③ 分子种类
④ 分子数目 ⑤ 元素种类 ⑥ 物质种类
(2)下图是某反应的微观示意图(其中“ ”和“
”和“ ”分别表示不同的原子)。
”分别表示不同的原子)。

① 反应后方框内应再填入
个“ ”微粒。
”微粒。
② 请从微观的角度分析化学变化的实质是 。
(3)在一密闭容器内有4种物质A、B、C、D,它们在一定条件下发生化学反应。其中A、B、C的微观示意图和反应前后各物质的质量如下表所示。

① x的值为 。
②若D的相对分子质量为46,该反应的化学方程式是 。
查看答案和解析>>
科目:初中化学 来源:2011-2012学年北京市西城区九年级上学期期末考试化学试卷 题型:填空题
(8分)质量守恒定律对科学发展具有重大意义。
(1)用如下图所示的3个实验验证质量守恒定律,其中不能达到实验目的的是 (填序号),理由是 。

(2)由质量守恒定律可知,化学反应前后一定不变的是 (填序号)。
① 原子种类 ② 原子数目 ③ 分子种类
④ 分子数目 ⑤ 元素种类 ⑥ 物质种类
(3)下图是某反应的微观示意图(其中“ ”和“ ”分别表示不同的原子)。

① 反应后方框内应再填入 个“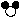 ”微粒。
”微粒。
② 请从微观的角度分析化学变化的实质是 。
(4)在一密闭容器内有4种物质A、B、C、D,它们在一定条件下发生化学反应。其中A、B、C的微观示意图和反应前后各物质的质量如下表所示。
|
物质 |
A |
B |
C |
D |
|
|
微观示意图 |
|
|
|
|
|
|
反应前质量/g |
100 |
1 |
1 |
46 |
|
|
反应后质量/g |
4 |
89 |
55 |
x |
① x的值为 。
②若D的相对分子质量为46,该反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com