
【题目】化学小组根据氨气还原氧化铜的反应,设计实验测定Cu元素的相对原子质量.
已知:①2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O ②氨气(NH3)是碱性气体
请结合下图回答问题.
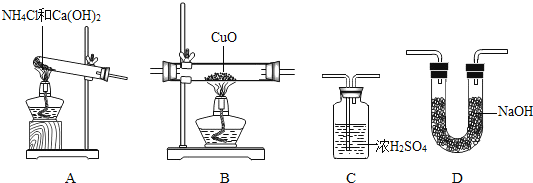
(1)将纯净干燥的氨气通入B中,观察到玻璃管内黑色固体变为亮红色,管口有液滴,同时生成空气中含量最多的气体,写出B中发生反应的化学方程式为_____.
(2)测定Cu元素相对原子质量的实验过程为:先称量CuO的质量,完全反应后测定生成水的质量,由此计算出Cu元素的相对原子质量.
Ⅰ.小组同学利用上图进行实验,下列装置连接合理的是(填序号,装置可重复使用)_____.
①ACBDC ②ADBCD ③ADBDC ④ABDC
Ⅱ.在本实验中,使测定结果偏大的原因可能是_____ (填序号);
①CuO未完全起反应 ②CuO不干燥
③CuO中混有不反应的杂质 ④NH4C1与Ca(OH)2混合物不干燥
Ⅲ.在本实验中,还通过测定_____的质量达到实验目的.
 科学实验活动册系列答案
科学实验活动册系列答案科目:初中化学 来源: 题型:
【题目】某种铁的冶炼流程如下图所示。
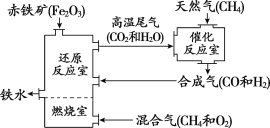
(1)“燃烧室”中CH4燃烧的作用是__________。
(2)整个流程中,化合价发生改变的元素有_________种。
(3)若用CO还原含160 t Fe2O3的赤铁矿,则炼出铁的质量为______t。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某学习小组做镁条在空气中燃烧实验时,发现生成物中有黑色固体。针对这一现象,他们猜想可能是镁与N2或CO2反应生成黑色固体。
针对猜想他们开展了如下探究活动。
【实验一】镁带与氮气的反应
(1)以下是获取氮气的方法及装置,其中得到氮气较纯的是______(填字母)
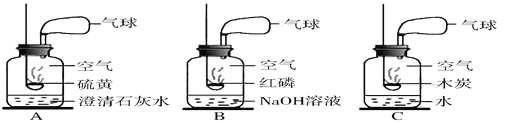
(2)燃烧镁带,观察现象
将镁带打磨光亮,点燃,伸入盛N2的集气瓶中,瓶内壁附着一层淡黄色的固体。
(3)实验结论:镁与氮气在点燃的条件下发生化合反应,生成淡黄色的氮化镁。该反应的化学方程式是:______________________________________________。
(4)实验反思:空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁?原因是_____________________________________ 。
【实验二】镁带与二氧化碳的反应
将燃着的镁带伸入盛CO2的集气瓶中,镁带剧烈燃烧,瓶内产生氧化镁和一种黑色固体单质,该黑色物质是___________。(写出化学式,下同)
【探究结论】
镁在空气中燃烧产生的黑色固体是镁与空气中___________反应产生的。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
青铜古称“吉金”,多为金黄色,主要是铜、锡、铅的合金。因其铜锈呈青绿色, 故名青铜。运用现代仪器分析青铜器及其锈蚀成分可以帮助我们对青铜器文物进行研究和保护。
研究人员利用X射线能谱仪对我国西周晚期某墓地出土的青铜容器、兵器、乐器的成分进行了分析,其中锡含量的分布频次如图。

研究人员利用X射线衍射分析技术对“镇国之宝”后母戊鼎西南足部位的锈蚀样品进行分析,结果如下:
| Cu2Cl(OH)3 | Cu2O | Cu2CO3(OH)2 | SnO2 | 其他 |
1 | 98% | 2% | 0 | 0 | 0 |
2 | 5% | 95% | 0 | 0 | 0 |
3 | 29% | 34% | 12% | 0 | 25% |
4 | 61% | 0 | 4% | 9% | 26% |
上述成分中,碱式氯化铜[Cu2Cl(OH)3]对青铜文物的危害极大,器物一旦沾染上这种物质,在环境湿度适宜的条件下,就会像患上瘟疫一样传染和蔓延,将会造成溃烂、穿孔,直至彻底瓦解。
依据文章内容回答下列问题。
(1)青铜名称的由来是_________。
(2)由锡含量的分布频次图推断,某件青铜兵器的锡含量可能是_______(填字母序号,下同)。
A 4% B 10% C 18% D 26%
(3)后母戊鼎西南足上的锈蚀成分中,属于氧化物的是__________。
A 氯化物 B 二氧化碳 C 水 D 氮气
(5)下列说法不合理的是__________。
A. 青铜器的锡含量可能与用途有关
B. 珍贵的青铜器应保存在绝氧、干燥的环境中
C. 保护青铜器时,无须关注环境中的氯化物
D. 后母戊鼎西南足的锈蚀样品中都含有Cu2Cl(OH)3和Cu2CO3(OH)2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是A、B两种固体物质的溶解度曲线,下列说法正确的是( )
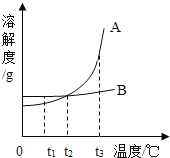
A. A的溶解度都大于B的溶解度
B. t2℃时,A、B两种饱和溶液中,溶质的质量分数相等
C. t1℃时,用等质量水配制的A、B饱和溶液中,所含溶质的质量:A>B
D. A、B两种饱和溶液都从t3℃降温到t2℃,析出的晶体的质量一定是:A>B
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】①~⑥为初中化学常见物质的相互转化关系(反应条件已略去).其中只有D、E、M为单质,H和L的组成元素相同.
①A+B→C ②A→D+E ③F→A+E ④G+K→H+A ⑤G+M→L+D ⑥Q+K→M+B
(1)写出物质的化学式:C_____、D_____、F_____.
(2)写出反应的化学方程式:④_____;⑤_____;⑥_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】BaCl2是一种重金属盐,其水溶液具有很强的毒性。若误服了BaCl2溶液可立即服用MgSO4溶液解毒。为测定某BaCl2溶液的溶质质量分数,现取100克BaCl2溶液,不断加入MgSO4溶液,反应过程中溶液总质量与加入MgSO4溶液的质量关系如图所示,当加入100克MgSO4溶液时,恰好完全反应。已知BaCl2+MgSO4=BaSO4↓+MgCl2请回答:

(1)M点时溶液中的溶质是___.(填名称);
(2)反应生成沉淀的质量为_____g
(3)求原BaCl2溶液的溶质质量分数____(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,A~H 分别是氢、氧、氮、氯、碳、钠、镁 、钙八种元素中的两种或几种组成的初中化学常见物质。“→”箭头表示物质间能转化,“﹣”表示物质间能反应),C、E是常用的灭火剂。请回答:

(1)G、E的化学式为___、____。
(2)C和_____(填物质名称) 反应可生成D。
(3)写出下列化学方程式:A→B:_____。F和H反应:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组同学利用右图装置探究可燃物燃烧的条件。
实验过程:
1将红磷和白磷分别放入两只试管中,一段时间后,A、B 试管中无明显现象。
2用气囊鼓入空气至白磷和红磷露出水面,A中白磷燃烧,B中无明显现象。
已知:红磷的着火点为240℃,白磷的着火点为40℃。
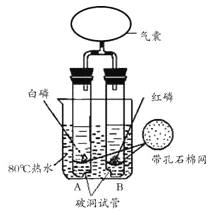
(1)仅通过对比实验②中露出水面的白磷和红磷可得到的结论是_____。
(2)实验过程中,能说明可燃物燃烧需要氧气的实验现象是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com