某纯净的可燃性气体仅含碳、氢两种元素,取一定质量的该气体在足量氧气中充分燃烧.若将燃烧产物通入足量的澄清石灰水中,得到白色沉淀15g;若用足量的固体氢氧化钠将燃烧产物全部吸收,增重12g.
(1)请计算燃烧产物中二氧化碳的质量;
(2)请计算燃烧产物中水的质量;
(3)请推断此可燃性气体的化学式.
【答案】
分析:可燃物完全燃烧,可燃物中的碳元素全部转化为二氧化碳、可燃物中的氢元素全部转化为水;
燃烧生成的二氧化碳与足量的氢氧化钙完全反应,生成不溶于水的白色沉淀碳酸钙;利用生成碳酸钙的质量计算燃烧生成二氧化碳的质量;
固体氢氧化钠既能吸收燃烧生成的水,又能吸收燃烧生成的二氧化碳,因此,增重的质量即燃烧生成二氧化碳和水的质量总和;
根据生成二氧化碳和水的质量计算出可燃物中C、H元素质量,然后利用原子个数比=

,求出分子中原子个数比而写出化学式.
解答:解:设燃烧产物中CO
2的质量为x.
CO
2+Ca(OH)
2=CaCO
3↓+H
2O
44 100
x 15g
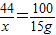
x=6.6g
则燃烧产物中水的质量=12g-6.6g=5.4g
该可燃性气体分子中碳、氢的原子个数比=
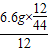
:
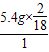
=1:4
即此可燃性气体的化学式为CH
4答:(1)燃烧产物中二氧化碳的质量为6.6g;
(2)燃烧产物中水的质量为5.4g;
(3)此可燃性气体的化学式为CH
4.
点评:化学变化过程中,元素的种类不变、元素的质量也不变;根据生成物中元素质量与反应物质元素质量相等,由生成物的质量可计算出反应物中元素质量.

 ,求出分子中原子个数比而写出化学式.
,求出分子中原子个数比而写出化学式.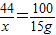
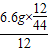 :
: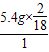 =1:4
=1:4

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案