


 æŚĖćĢāæر±¾©ø¾Å®¶łĶƳö°ęÉēĻµĮŠ“š°ø
æŚĖćĢāæر±¾©ø¾Å®¶łĶƳö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ĪĀ¶Č/”ę | 0 | 20 | 40 | 60 | 80 | 100 |
| Čܽā¶Č/g | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÄʵĻÆŗĻĪļŌŚČÕ³£Éś»īÖŠÓ¦ÓĆ¹ć·ŗ£®
£Ø1£©NaOHČÜŅŗ³£ÓĆÓŚ¼¦ÉįĻū¶¾£¬NaOHµÄĖ×³ĘŹĒ””””£®
£Ø2£©“ĪĀČĖįÄĘ£ØNaClO£©ŹĒ”°84”±Ļū¶¾ŅŗµÄÓŠŠ§³É·Ö£¬“ĪĀČĖįÄĘÖŠĀČŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ””””¼Ū£®
£Ø3£©Ģ¼ĖįĒāÄĘŹĒ·¢½Ķ·ŪµÄÓŠŠ§³É·Ö£¬Ģ¼ĖįĒāÄĘÓėĻ”ŃĪĖį·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ””””£®
£Ø4£©Ź³ŃĪŹĒ×īÖŲŅŖµÄµ÷Ī¶Ę·£®“Ó½Ó½ü±„ŗĶµÄŹ³ŃĪČÜŅŗÖŠ»ńµĆŹ³ŃĪ¾§Ģ壬Ӧ²ÉČ”µÄ·½·ØŹĒ””£®
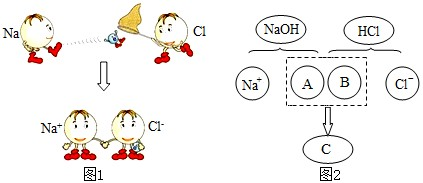
£Ø5£©¹¹³ÉNaCl¾§ĢåµÄĄė×Ó·ūŗÅ·Ö±šŹĒ”””””¢””﹣””£®
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com