
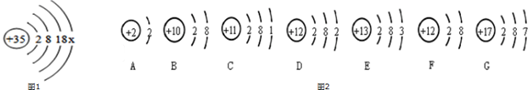
分析 (1)根据原子中核内质子数等于核外电子数分析X的值,根据最外层电子数目的特点分析的是电子的情况,写出形成的离子的符号;
(2)根据同种元素的质子数相同、相对稳定结构的特点和决定元素化学性质的微粒考虑.
解答 解:(1)原子中核内质子数等于核外电子数,即:35=2+8+18+X,所以X=7;由于最外层电子数是7大于4,易得到一个电子形成溴离子,符号为:Br-;
(2)由图2表示的微粒可知,DF微粒的质子数相同,属于同一种元素;A、B的微粒核内质子数等于核外电子数,属于原子,最外层电子数达到了稳定结构,性质相似;G的最外层电子数与Br的相同,化学性质相似;图F表示的元素是镁元素,原子的核外有三个电子层,位于元素周期表的第三周期.
故答案为:(1)7;Br-;(2)DF;AB;G;三.
点评 解答本题关键是要知道原子结构示意图中核内质子数等于核外电子数,知道金属元素的判断方法,知道相对稳定结构的特点.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 化学是一门以实验为基础的科学,实验是学习化学的一条重要途径.根据以下实验解答下列问题:
化学是一门以实验为基础的科学,实验是学习化学的一条重要途径.根据以下实验解答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
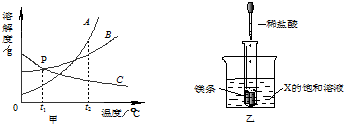
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com