
ЎҫМвДҝЎҝТөЙПЙъІъөзВ·°еј°ҙҰАн·ПТәөД№ӨТХБчіМИзПВЈә
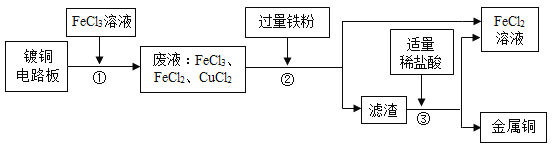
ЈЁ1Ј©УЙІҪЦиўЩҝЙЕР¶ПFeCl3УлНӯ·ҙУҰЙъіЙөДБҪЦЦІъОпКЗ________әН________ЎЈ
ЈЁ2Ј©ІҪЦиўЪјУИл№эБҝөДМъ·ЫЈ¬іэДЬУл·ПТәЦРCuCl2·ҙУҰНвЈ¬»№ҝЙ·ўЙъ·ҙУҰөД»ҜС§·ҪіМКҪОӘ_______ЎЈёГ·ҙУҰөД»щұҫАаРНКЗЈә_______·ҙУҰЎЈ
ЈЁ3Ј©ІҪЦиўЫјУИлПЎСОЛбЈ¬ід·ЦҪБ°иЈ¬өұ№ЫІмөҪ_______________ПЦПуКұЈ¬ЛөГчВЛФьЦ»КЈНӯЎЈ
ЈЁ4Ј©ІҪЦиўЪўЫЛщөГFeCl2ҝЙУлТ»ЦЦөҘЦК·ўЙъ»ҜәП·ҙУҰЙъіЙFeCl3Ј¬КөПЦСӯ»·К№УГЎЈёщҫЭЦКБҝКШәг¶ЁВЙҝЙНЖІвёГөҘЦКөД»ҜС§КҪОӘCl2Ј¬ТСЦӘCl2УлH2O·ҙУҰөД»ҜС§·ҪіМКҪОӘЈәCl2Ј«H2O ЈҪHCl Ј«HClO,ФтCl2УлЗвСх»ҜёЖИЬТә·ҙУҰөД»ҜС§·ҪіМКҪОӘЈә__________________ЎЈ
Ўҫҙр°ёЎҝFeCl2 CuCl2 Fe+2FeCl3ЁT3FeCl2 »ҜәП І»ФЩУРЖшЕЭІъЙъ 2CaЈЁOHЈ©2+2Cl2ЁTCaCl2+CaЈЁClOЈ©2+2H2O
ЎҫҪвОцЎҝ
ЈЁ1Ј©Пт¶ЖНӯөДөзВ·°еЦРјУИлВИ»ҜМъИЬТәәуЙъіЙБЛВИ»ҜНӯәНВИ»ҜСЗМъЈ¬јҙОӘНӯәНВИ»ҜМъИЬТә·ҙУҰөДІъОпЈ»
ЈЁ2Ј©МъДЬУлВИ»ҜМъ·ҙУҰЙъіЙВИ»ҜСЗМъЈ¬»ҜС§·ҪіМКҪОӘFe+2FeCl3ЁT3FeCl2Ј»КфУЪ»ҜәП·ҙУҰ
ЈЁ3Ј©јУИл№эБҝөДМъ·Ы№эВЛәуөДөГөҪВЛФьУҰёГОӘМъ·ЫәННӯөД»мәПОпЈ¬ЛщТФјУИлСОЛбәуЈ¬МъТӘәНСОЛб·ҙУҰІъЙъЗвЖшЈ¬¶шНӯІ»·ҙУҰЈ¬ЛщТФЦБІ»ФЪІъЙъЖшЕЭКұөГөҪөД№ММеЦ»УРНӯөҘЦКЈ»
ЈЁ4Ј©Cl2УлЗвСх»ҜёЖИЬТә·ҙУҰЙъіЙВИ»ҜёЖЎўҙОВИЛбёЖәНЛ®Ј¬»ҜС§·ҪіМКҪОӘ2CaЈЁOHЈ©2+2Cl2ЁTCaCl2+CaЈЁClOЈ©2+2H2OЎЈ
№Кҙр°ёОӘЈәЈЁ1Ј©FeCl2Ј»CuCl2Ј»
ЈЁ2Ј©Fe+2FeCl3ЁT3FeCl2Ј»»ҜәПЈ»
ЈЁ3Ј©І»ФЩУРЖшЕЭІъЙъЈ»
ЈЁ4Ј©2CaЈЁOHЈ©2+2Cl2ЁTCaCl2+CaЈЁClOЈ©2+2H2O.


 ФД¶БҝміөПөБРҙр°ё
ФД¶БҝміөПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПтКўУР20g10%ЗвСх»ҜДЖИЬТәөДЙХұӯЦРЦрөОөОИл7.3%өДПЎСОЛб,ПВБРКЗ№ШУЪИЬТәЧЬЦКБҝ»тИЬТәpHЛжСОЛбЦКБҝұд»ҜөД№ШПөНј(QөгұнКҫЗЎәГНкИ«·ҙУҰ)ЎЈЖдЦРХэИ·өДКЗ

A. A B. B C. C D. D
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘИЬТәөДөјөзРФУлөҘО»Ме»эДЪАлЧУөДКэДҝЎўАлЧУЛщҙшөзәЙ¶аЙЩУР№ШЈ¬өҘО»Ме»эДЪАлЧУКэДҝФҪ¶аЈ¬өјөзРФФҪЗҝЈ»АлЧУЛщҙшөзәЙФҪ¶аЈ¬өјөзРФФҪЗҝЈЁИзБҪёцВИАлЧУәНТ»ёцБтЛбёщАлЧУөјөзРФПаөұЈ©ЎЈПЦПтә¬УРCaЈЁOHЈ©2әНNaOHөД»мәПТәЦРНЁИлCO2ЖшМеЈ¬ПВБРІвөГИЬТәөјөзРФЈЁУГЎ°өзБчЗҝ¶ИIЎұұнКҫЈ©ұд»ҜУлНЁИлCO2ЖшМеМе»эЈЁVЈ©№ШПөНјПуХэИ·өДКЗЈЁЎЎЎЎЈ©
A. 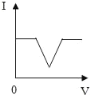 B.
B. 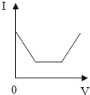
C. 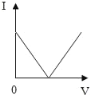 D.
D. 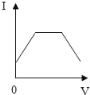
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝІЭЛбҫ§Ме(H2C2O4ЎӨ2H2O)ИЫөгҪПөНЈ¬јУИИ»бИЫ»ҜЎўЖш»ҜәН·ЦҪвЎЈІЭЛб(H2C2O4)КЬИИ»б·ЦҪвЈ¬ЛьУлЗвСх»ҜёЖөД·ҙУҰОӘЈәH2C2O4+Ca(OH)2==CaC2O4Ўэ(°ЧЙ«)+2H2OЎЈјЧЎўТТБҪН¬С§¶ФІЭЛбКЬИИ·ЦҪвөДІъОпЧчИзПВМҪҫҝЈә
ЧКБПЈәОЮЛ®БтЛбНӯУцЛ®»бұдіЙА¶Й«ЎЈ
(1)ІВПлУлјЩЙиЈә
өЪТ»ЦЦЈәІЭЛб·ЦҪвЙъіЙCO2әНH2Ј»
өЪ¶юЦЦЈәІЭЛб·ЦҪвЙъіЙCO2ЎўCOәНH2OЈ»
өЪИэЦЦЈәІЭЛб·ЦҪвЈәH2C2O4![]() CO2Ўь+H2O(ОҙЕдЖҪ)Ј»
CO2Ўь+H2O(ОҙЕдЖҪ)Ј»
УРН¬С§ҙУАнВЫЙПҫНҝЙЕР¶ПөЪИэЦЦјЩЙиІ»іЙБўЈ¬АПКҰТІИПОӘХвТ»ЕР¶ПКЗХэИ·өДЈ¬ёГН¬С§ЕР¶ПөДАнВЫТАҫЭКЗ____ЎЈ
(2)ЙијЖУлКөСйЈәјЧЎўТТБҪН¬С§·ЦұрЙијЖБЛПВНјЛщКҫөДAЎўBБҪМЧКөСйЧ°ЦГ(НјЦРМъјЬМЁВФИҘ)ЎЈ
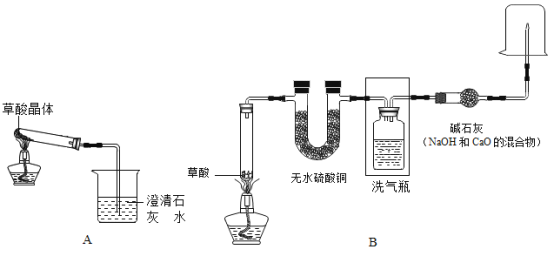
ўЩјЧН¬С§°ҙAЧ°ЦГКөСйЈ¬№ЫІмөҪіОЗеКҜ»ТЛ®ұд»лЧЗЈ¬ИПОӘҙЛПЦПуКЗУЙІЭЛбҫ§МеКЬИИ·ЦҪвІъЙъөДCO2ЛщөјЦВЈ¬ҙЛЕР¶П_____(МоЎ°СПГЬЎұ»тЎ°І»СПГЬЎұ)ЎЈ
ўЪТТН¬С§өДBЧ°ЦГНј·ҪҝтДЪөДТЗЖчОҙ»ӯНкХыЈ¬ЗлДг°пЛы»ӯНкХы(ЦұҪУ»ӯФЪНјЙП»тҙрМвҝЁЙП) ____ЎЈТТН¬С§°ҙBЧ°ЦГКөСйЈ¬ҝҙөҪОЮЛ®БтЛбНӯУЙ°ЧұдА¶Ј¬ПҙЖшЖҝЦРіОЗеКҜ»ТЛ®ұд»лЧЗЎЈФЪјвЧм№ЬҝЪөгИјКЈУаЖшМеЈ¬»рСжЙП·ҪХЦТ»ёц__ЙХұӯЈ¬УР°ЧЙ«№ММеЙъіЙЈ¬ЦӨГчІъОпЦРУР___Ј»»»Т»ёцёЙЎўАдЙХұӯХЦФЪ»рСжЙП·ҪЈ¬ДЪұЪОЮПЦПуЈ¬ЦӨГчІъОпЦРОЮH2ЎЈ
(3)ҪбВЫУлЛјҝјЈә
ўЩІЭЛбКЬИИ·ЦҪвөД»ҜС§·ҪіМКҪОӘЈә_____ЎЈ
ўЪИфКЎВФBЧ°ЦГ·ҪҝтДЪөДТЗЖчЈ¬ХыМЧЧ°ЦГТІДЬЦӨГчІъОпЦРУРCO2(јЩЙиГҝІҪ¶ј·ҙУҰНкИ«)Ј¬·Ҫ·ЁКЗЈә____ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝРЎГчН¬С§¶ФЛщС§Іҝ·Ц»ҜС§ЦӘК¶№йДЙИзПВЈ¬ЖдЦРХэИ·өДКЗ
A | РлұжЗеөДОпЦК | B | іхЦР»ҜС§ЦРіЈјыөДЎ°ИэЎұ |
ёЙұщІ»КЗұщЎӘЎӘ¶шКЗ№ММеCO2 ҙҝјоІ»КЗјоЎӘЎӘ¶шКЗСО Л®ТшІ»КЗТшЎӘЎӘ¶шКЗ№Ҝ | ИэЦЦҝЙИјРФЖшМеЎӘЎӘCOЎўH2ЎўN2 ИэЦЦУР¶ҫОпЦКЎӘЎӘCOЎўСЗПхЛбДЖЎўH2 ИэЦЦ»щұҫБЈЧУЎӘЎӘФӯЧУЎў·ЦЧУЎўАлЧУ | ||
C | »ҜС§ҫЮҪіј°ЖдҪЬіц№ұПЧ | D | ·ыәЕЦРКэЧЦЎ°2ЎұөДТвТе |
ХЕЗаБ«ЎӘЎӘІвБҝПа¶ФФӯЧУЦКБҝ АӯНЯОэЎӘЎӘІв¶ЁҝХЖшөДЧйіЙ әоөВ°сЎӘЎӘ·ўГчБӘәПЦЖјо·Ё | 2OЈәБҪёцСх·ЦЧУ
O2ЈәБҪёцСхФӯЧУ |
A.AB.BC.CD.D
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЎ°МҪПХ¶УФұЎұ©Ғ©ҒСОЛбЈ¬І»РЎРДЧЯҪшБЛ»ҜС§ГФ№¬Ј¬І»ЦӘФхСщЧЯіцАҙЈ¬ТтОӘГФ№¬УРРн¶аЎ°іФИЛөДТ°КЮЎұЈЁјҙДЬУлСОЛб·ҙУҰөДОпЦК»тЛ®ИЬТәЈ©Ј¬СОЛбұШРлұЬҝӘЛьГЗЈ¬·сФтҫНОЮ·ЁНЁ№эЎЈ
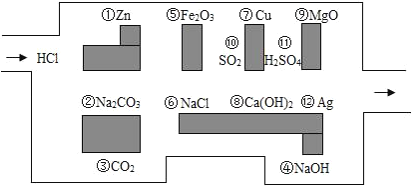
ЈЁ1Ј©ЗлДг°пЦъЛьЧЯіцГФ№¬ЈЁЗлУГНјЦРОпЦКЗ°өДРтәЕБ¬ҪУЖрАҙұнКҫЛщЧЯөДВ·ПЯЈ©ЎЈ_____ЎЈ
ЈЁ2Ј©ФЪДЬЎ°іФөфЎұСОЛбөД»ҜС§·ҙУҰЦРЈ¬КфУЪёҙ·ЦҪв·ҙУҰөДУР_____ёцЎЈЖдЦРДЬЎ°іФөфЎұСОЛбөДСОКЗ_____ ЈЁМоРҙОпЦКГыіЖЈ©Ј¬РҙіцёГ·ҙУҰөД»ҜС§·ҪіМКҪ_____ЎЈ
ЈЁ3Ј©ФЪІ»ДЬУлСОЛб·ҙУҰөДОпЦКЦРЈ¬ДЬУліОЗеКҜ»ТЛ®·ҙУҰөДОпЦККЗ_____ЈЁМоРҙОпЦКРтәЕЈ©
ЈЁ4Ј©Из№ыҪ«СОЛб»»іЙПхЛбұөЈ¬ЛьДЬСШЧЕСОЛбЧЯіцөДВ·ПЯЎ°ЧЯіцЎұХвёцГФ№¬ВрЈҝОӘКІГҙЈҝ_____ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝИзНјЛщКҫЈ¬ҙтҝӘ·ЦТәВ©¶·Ј¬К№ЖдЦРөДОЮЙ«ТәМеУлКФ№ЬЦРөД№ММеҪУҙҘ·ҙУҰЈ¬ҝЙ№ЫІмөҪЖшЗтХНҙуПЦПуЈ¬Зл·ЦұрРҙіцТ»ёц·ыәПНјЦРПЦПуәНПВБРТӘЗуөД»ҜС§·ҪіМКҪЈә
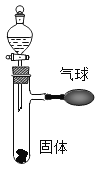
(1)·ЦҪв·ҙУҰ________________________________________________
(2)»ҜәП·ҙУҰ_________________________________________________
(3)ёҙ·ЦҪв·ҙУҰ________________________________________________
(4)ЦГ»»·ҙУҰ________________________________________________
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ(Т»)ВБј°Жд»ҜәПОпКЗОТГЗИХіЈЙъ»оЦРІ»ҝЙИұЙЩөДОпЦКЈ¬ИзәҪҝХәҪМмІДБПЎӘУІВБЎЈ
(1)AlәНCuSO4ИЬТә·ҙУҰөД»ҜС§·ҪіМКҪОӘ____Ј¬ёГ·ҙУҰЛөГч____Ј»
(2)Йъ»оЦРВБұИМъёьДНёҜКҙөДФӯТт____(УГ»ҜС§·ҙУҰ·ҪіМКҪҪвКН)ЎЈ
(¶ю)ДіС§ЙъФЪС§П°СОөДРФЦККұЧцБЛВИ»ҜВБИЬТәәНЗвСх»ҜДЖИЬТә·ҙУҰөДКөСйЎЈёГС§ЙъПтВИ»ҜВБИЬТәЦРЦрөОөОјУЗвСх»ҜДЖИЬТәКұЈ¬·ўПЦИЬТәЦРУРіБөнЙъіЙЈ¬ЗТіБөнБҝПИФц¶аәујхЙЩЦұЦБПыК§ЎЈҫӯІйЧКБПЦӘЈә
Al(OH)3КЗТ»ЦЦБҪРФЗвСх»ҜОпЈ¬ЛьјИҝЙТФУлЛб·ҙУҰУЦҝЙТФУлјо·ҙУҰ¶јЙъіЙСОәНЛ®ЎЈЛьУлјо·ҙУҰөД»ҜС§·ҪіМКҪОӘЈәAl(OH)3Ј«NaOH=NaAlO2Ј«2H2OЈ¬NaAlO2ҝЙИЬУЪЛ®ЎЈ
(1)ёГС§ЙъҪ«100.0g53.4%өДAlCl3ИЬТәәН100.0gNaOHИЬТә»мәПЈ¬ід·Ц·ҙУҰәу№эВЛөГөҪ27.3gіБөнЈ¬ФтЛщјУNaOHИЬТәөДЦКБҝ·ЦКэОӘ__ЎЈ
(2)ёГС§ЙъБнҪ«agУІВБ(MgЎўAlЎўCuЎўSiәПҪр)ИЬУЪ200.0gСОЛбЦРЈ¬ід·Ц·ҙУҰәу№эВЛЈ¬ПтВЛТәЦРЦрөОөОјУ20.0%өДNaOHИЬТәЦБ№эБҝЈ¬ІъЙъөДіБөнУлNaOHИЬТәөДЦКБҝ№ШПөИзПВНјЈә
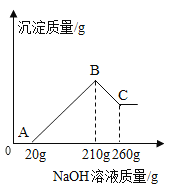
ўЩOЎъA¶ОөД»ҜС§·ҙУҰ·ҪіМКҪОӘ____Ј»
ўЪСОЛбөДЦКБҝ·ЦКэКЗ____ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәіхЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪәк№ЫЎўОў№ЫәН·ыәЕЦ®јдҪЁБўБӘПөКЗ»ҜѧѧҝЖөДМШөгЎЈ
ЈЁ1Ј©НјТ»ЦР![]() КЗ_____Ј»
КЗ_____Ј»

ЈЁ2Ј©ФЪ№ҜЎўВИ»ҜДЖЎў¶юСх»ҜМјИэЦЦОпЦКЦРЈ¬УЙ·ЦЧУ№№іЙөДКЗ_____ЈЁМо»ҜС§КҪЈ©ЎЈ
ЈЁ3Ј©ИзНј¶юЛщКҫЈ¬ОўБЈ![]() ФЪ»ҜС§·ҙУҰЦРИЭТЧ_____ЈЁМоЎ°өГөҪЎұ»тЎ°К§ИҘЎұЈ©өзЧУЈ»ОўБЈAЎўBЎўCЎўDЎўEЦРКфУЪСфАлЧУөДКЗ_____ЈЁМоЧЦДёЈ¬ПВН¬Ј©Ј¬КфУЪН¬Т»ЦЦФӘЛШөДКЗ_____ЎЈ
ФЪ»ҜС§·ҙУҰЦРИЭТЧ_____ЈЁМоЎ°өГөҪЎұ»тЎ°К§ИҘЎұЈ©өзЧУЈ»ОўБЈAЎўBЎўCЎўDЎўEЦРКфУЪСфАлЧУөДКЗ_____ЈЁМоЧЦДёЈ¬ПВН¬Ј©Ј¬КфУЪН¬Т»ЦЦФӘЛШөДКЗ_____ЎЈ

ЈЁ4Ј©ИзНјИэЛщКҫЈ¬¶ФҙЛ·ҙУҰРрКцХэИ·өДКЗ_____ЈЁМоЧЦДёЈ©ЎЈ

a.·ҙУҰЗ°әуёчФӘЛШ»ҜәПјЫҫщОҙёДұд b.ёГ·ҙУҰЦР![]() Ул
Ул![]() өДЦКБҝұИКЗ
өДЦКБҝұИКЗ![]()
c.јУИлҙЯ»ҜјБҝЙМбёЯІъОпЦКБҝ d.АыУГҙЛ·ҙУҰҝЙјхЙЩУР¶ҫЖшМеөДЕЕ·Е
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com