
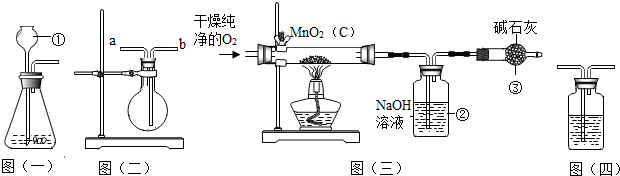
分析 (1)熟悉常用仪器的名称和用途,根据装置的特点选择药品制取氧气,写出反应的化学方程式;
(2)根据氧气的密度与水的密度关系分析进气口,在干燥氧气时常将氧气通入浓硫酸中;
(3)根据碱石灰能与二氧化碳反应分析回答.
(4)根据二氧化碳的检验方法分析回答;
(5)分析装置质量差出现的原因,得出二氧化碳的质量,根据变化前后元素质量不变,求出混合粉末中木炭质量,再计算二氧化碳质量,最后用二氧化碳质量与混合粉末质量比,求出粉末中二氧化锰的质量分数
解答 解:(1)由图示可知,仪器①的名称是长颈漏斗.如果该实验选择图(一)装置来制取氧气,属于固液常温下反应制取氧气,则所用药品为2H2O2、MnO2,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.故答为:长颈漏斗,H2O2、MnO2,2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)用图(二)装置可收集和干燥氧气:若烧瓶充满水来收集氧气,由于氧气的密度小于水的密度,气体应从a端通入;若在烧瓶内装入浓硫酸进行干燥气体,气体应从b端通入.故答:a,b.
(3)由氧气和碳让反应生成了二氧化碳,碱石灰能与二氧化碳反应,所以,装置③中装有碱石灰,其作用是吸收空气中的二氧化碳,排除干扰.
故答:吸收空气中的二氧化碳.
(4)为检验装置②中排出气体是否含有二氧化碳以检验二氧化碳被完全吸收,可在装置②与③之间加入澄清石灰水,澄清石灰水不变浑浊,可以说明二氧化碳被全部吸收;
故选B;
(5)图㈢中用来吸收产生的二氧化碳的装置②反应前后的质量差为1.1 g,
所以增重的量即为吸收的二氧化碳的量,即吸收了二氧化碳质量为1.1g,
其中含C元素质量=1.1g×$\frac{12}{44}$×100%=0.3g,即混合粉末中含有0.3g木炭粉,
则含有黑色二氧化锰的质量分数=$\frac{5.0g-0.3g}{5g}$×100%=94%
故答:94%.
点评 分析探究过程中各装置的作用,理清探究思路,根据探究思路逐步进行分析,找出符合探究思路的解决问题的方法.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Cu+2HCl═CuCl2+H2↑ | B. | Zn+2AgCl═ZnCl2+Ag | ||
| C. | Fe+ZnSO4═FeSO4+Zn | D. | Cu+Hg(NO3)2═Cu(NO3)2+Hg |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 我国自主研发的新药帕拉米韦注射液获批上市,帕拉米韦(C15H28N4O4)是目前世界上治疗H7N9型流感病毒患者的良药.请回答下列问题:
我国自主研发的新药帕拉米韦注射液获批上市,帕拉米韦(C15H28N4O4)是目前世界上治疗H7N9型流感病毒患者的良药.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 元素周期表是学习化学的重要工具.如图是元素周期表中的一格,从中获取的信息错误的是( )
元素周期表是学习化学的重要工具.如图是元素周期表中的一格,从中获取的信息错误的是( )| A. | 该元素的原子序数为9 | B. | 该元素属于非金属元素 | ||
| C. | 该元素的原子核外有19个电子 | D. | 该元素的相对原子质量为19.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com