
分析 解答此类题目时要反复阅读题意,明确题目的要求和前后的关联,然后进行解答.(1)把反应物研成粉末是为了加快反应速率.
(2)如果生成物和反应物中都有某种物质,这种物质一般可循环利用;
(3)根据碳酸钙和稀盐酸的反应书写化学方程式;
(4)①多个装置进行实验时首先要检查装置的气密性;根据碱石灰的性质判断,它能吸收水和二氧化碳.
②根据E装置的作用判断,
(5)①根据反应物的反应规律判断G点的物质;
②根据反应物和生成物书写化学方程式.
解答 解:(1)将CaCO3研成粉末,可以增大反应物的接触面积,其目的是加快反应速率.
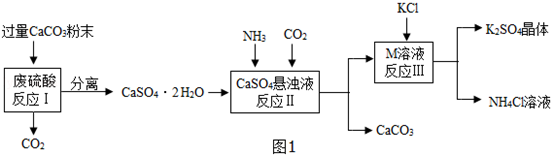
(2)观察上述流程,发现二氧化碳和碳酸钙既是反应物也是生成物,故可循环使用的物质有CO2和CaCO3.
(3)碳酸钙能与稀盐酸反应,硫酸钙和稀盐酸不反应,故分离所得的CaSO4•2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式CaCO3+2HCl=CaCl2+CO2↑+H2O.
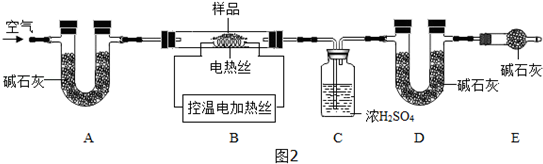
(4)为了测定CaSO4•2H2O和CaCO3的质量比x:y,①实验前首先要检查装置的气密性,再装入样品.装置A的作用是除去空气中的CO2和H2O,防止它们影响实验结果.②装置E的作用是吸收空气中的水和二氧化碳,如没有装置E,则实验测定结果将偏小.通过装置C可确定生成水的质量,故还可选用上述的bc两个数据组合也可求出x:y的值.
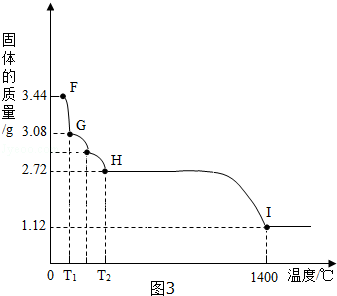
(5)CaSO4•2H2O受热会逐步失去结晶水.取纯净CaSO4•2H2O固体,放在(5)的实验装置B中进行加热,①G点处减少的质量是失去了部分结晶水后的质量,故此时固体的化学式是CaSO4•H2O.②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,说明生成了二氧化硫气体,则H~I段发生反应的化学方程式为 2CaSO4$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2↑+O2↑.
故答案为:(1)加快反应速率(或使反应更充分或提高原料的利用率等).
(2)CaCO3
(3)CaCO3;CaCO3+2HCl=CaCl2+CO2↑+H2O
(4)①检查装置的气密性. 除去空气中的CO2和H2O.②b、c;偏小;
(5)①CaSO4•H2O ②2CaSO4$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2↑+O2↑.
点评 此题全面考查了学生对知识的掌握和应用能力,难度比较大,解答时一定要注意知识的前后的联系和综合运用.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
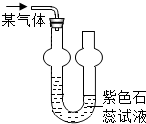 双球洗气管常用于气体除杂、干燥、吸收(可防倒吸)等实验.为吸收某气体并检验其性质进行图中实验,发现紫色石蕊试液变红色.请根据表中数据判断左方进入的气体是( )
双球洗气管常用于气体除杂、干燥、吸收(可防倒吸)等实验.为吸收某气体并检验其性质进行图中实验,发现紫色石蕊试液变红色.请根据表中数据判断左方进入的气体是( )| O2 | HCl | NH3 | CO2 | |
| 通常情况下,1体积水 能吸收的气体的体积数 | 0.031 | 500 | 700 | 1 |
| A. | NH3 | B. | HCl | C. | CO2 | D. | O2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 区分硝酸铵固体和氢氧化钠固体--水 | |
| B. | 比较黄铜片和铜片的硬度--互相刻划 | |
| C. | 区分硫酸铜溶液和氯化铜溶液--观察颜色 | |
| D. | 除去粗盐中难溶性杂质--加水充分溶解,过滤,蒸发结晶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com