
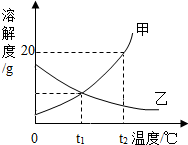
 如图是甲、乙两种固体物质的溶解度曲线,回答:
如图是甲、乙两种固体物质的溶解度曲线,回答:分析 (1)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)饱和溶液变为不饱和溶液的方法有加入溶剂、升高温度;
(3)根据该温度下甲的溶解度分析解答;
(4)据物质溶解度随温度变化可判断提纯物质的方法,并明确饱和溶液中溶质的质量质量分数的计算式$\frac{溶解度}{溶解度+100g}$×100%,进而分析温度变化溶质的质量分数变化情况.
解答 解:(1)t1℃时,甲、乙两物质的溶解度曲线相交于一点,二者的溶解度相同;
(2)甲的溶解度随温度升高而增大,所以在t2℃甲的饱和溶液变为不饱和溶液,可采用的方法是升高温度(或增加溶剂);
(3)t2℃时甲的溶解度是20g,即100g水中最多溶解20g的甲,所以将25g甲放入100g水中最多溶解20g,所得溶液中溶质和溶剂的质量比为20g:100g=1:5;
(4)A、甲的溶解度随温度升高而增大,乙的溶解度随温度升高而减小,所以甲中含有少量的乙可采用降温结晶的方法提纯甲,故错误;
B、t2℃时,不知溶液中溶质、溶剂的质量,所以无法判断溶液中溶质的质量分数大小,故错误;
C、t2℃时甲的溶解度大于乙的溶解度,所以将等质量的甲乙两物质分别加水配成饱和溶液,需要水的质量乙比甲多,所以甲溶液质量比乙溶液质量小,正确;
D、由于甲的溶解度随温度升高而增大,乙的溶解度随温度升高而减小,所以将t1℃甲乙的饱和溶液升温至t2℃时,甲溶液的溶质质量分数不变,乙析出晶体,溶质的质量减小,则溶质的质量分数减小,故错误;
故答案为:(1)t1℃时,甲、乙两物质的溶解度相同;
(2)升高温度(或增加溶剂);
(3)1:5;
(4)C.
点评 本题主要考查了固体溶解度曲线所表示的意义及根据固体溶解度曲线解决相关的问题,从而培养学生对知识的应用能力.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液、稀盐酸 | B. | 氮气、氢气 | ||
| C. | 硝酸钡溶液、稀硫酸 | D. | 银、硝酸锌溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图表示硝酸钾和氯化钠的溶解度曲线.请根据图回答下列问题:
如图表示硝酸钾和氯化钠的溶解度曲线.请根据图回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 二氧化锰粉末用量(克) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间(秒) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
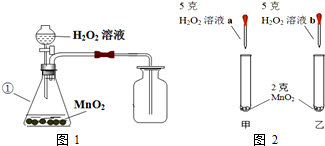
| 溶质质量分数 | 10% | 3% |
| 密度(单位g/mL) | 1.024 | 0.991 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com