
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源:江苏省姜堰市第四中学2012届九年级三模化学试题 题型:058
在户外聚会时,化学老师点燃了一支自制的蜡烛,同学们发现这支蜡烛不易被风吹灭,原来在蜡烛的棉芯里藏了两根相互缠绕的银白色金属丝.老师指出金属丝的成分可能是Mg、Al、Fe中的一种或两种.回校后,老师提供了Mg、Al、Fe三种已知金属和MgSO4、Al2(SO4)3、FeSO4、CuSO4四种盐溶液,以及未知金属的样品.指导同学们先进行了参照实验,之后探究未知金属的成分.
(1)三种已知金属的参照实验

用“▲”标记的实验有相同的现象,“▲”处应记录的是________;表中的“灰黑色固体”的成分为________.Al与CuSO4溶液反应的化学方程式为________.
(2)未知金属成分的探究
该小组同学将两根未知金属丝分开,如图所示放入CuSO4溶液中,观察到的现象记录如下:


通过与参照实验对比,可以获得的结论是:两种金属丝的成分不同,有气泡冒出的金属丝成分是________.用老师提供的试剂再进行一个实验,就能证明另外一种金属丝的成分,则选用的试剂为________.
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验方案 | 实验现象 | |
| 甲 | 取少量黑色物质用磁铁吸引 | 黑色物质全部被磁铁吸引 |
| 乙 | 取少量黑色物质加入30%热的盐酸中 | 无气泡、溶液颜色变成黄绿色 |
| 丙 | 取少量黑色物质加入硫酸铜溶液中 | 无任何现象 |

| 温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
 Fe3O4+4H2O
Fe3O4+4H2O
 质量差会偏小而影响计算、分析,你认为他们的理由是______.
质量差会偏小而影响计算、分析,你认为他们的理由是______.查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
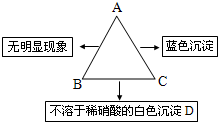
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
含镁3%~5%的镁铝合金是轮船制造、化工生产、机械制造等行业的重要原材料。现有一块质量为w g的镁铝合金,某研究性学习小组欲测定其中镁的质量分数。
【查阅资料】已知铝与NaOH溶液反应生成易溶于水的偏铝酸钠(NaAlO2:)和H2,化学方程式为:2A1+2NaOH+2H2O=2NaAlO2+3H2↑;镁不与NaOH溶液反应。氢氧化铝能与氢氧化钠溶液发生反应生成易溶于水的偏铝酸钠(NaAlO2:)和H2O,化学方程式为:A1(OH)3+NaOH=NaAlO2+2H2O;氢氧化镁不与氢氧化钠溶液反应。
【提出猜想】利用镁铝与酸、铝与碱、氢氧化铝与碱反应的化学性质来测定合金中镁的质量分数。
【设计方案】研究小组设计了不同的实验方案。
方案l:镁铝合金与过量盐酸反应测定生成气体在标准状况下的体积为V1L;
方案2:镁铝合金与过量NaOH溶液充分反应后,过滤、洗涤、干燥、称量剩余固体的质量为w1g;
方案3:镁铝合金与过量盐酸溶液反应后再与过量NaOH溶液反应,过滤、洗涤、干燥、称量沉淀的质量为w2g。
【问题讨论】请你参与研究小组的研究过程,并回答有关问题:
(1)研究小组利用如图所示实验装置,按照方案1进行了实验。

①装置中仪器a的名称是 。
②实验装置中有一处明显错误,请指出
(2)方案2中剩余固体是 ;若按方案2进行实验,测得镁的质量分数为 。
(3)方案3中“过滤”得到的沉淀是 。
(4)某同学又设计了与上述方案原理不同的方案4,也能测得镁的质量分数。请你在横线上填写合适的内容,将该方案补充完整。
方案4:镁铝合金与 反应测定生成气体在标准状况下的体积为V2L。
【方案评价】
(5)在实验方案1-4中,你认为最佳的实验方案是 。
查看答案和解析>>
科目:初中化学 来源:2010年湖南省长沙市铁路一中中考化学模拟试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com