
【题目】向 200.0g AgNO3 溶液中加入 m 克 Al 和 Cu 的混合粉末,搅拌,充分反应后过滤、洗涤、 干燥得到32.4g固体。向滤液中滴加稀盐酸,产生白色沉淀,下列说法正确的是
A.滤液的质量为 167.6g
B.混合粉末的质量可能为 8.0 克
C.过滤所得物体中加入稀盐酸可能会有气体生成
D.原 AgNO3 溶液的溶质质量分数为 25.5%
【答案】B
【解析】
根据题目中滤液加入稀盐酸有白色沉淀产生可以确定AgNO3溶液有剩余,Al 和 Cu 全部反应,生成的 32.4g 固体都是 Ag。
A、向200.0gAgNO3溶液中加入 mg Al 和 Cu 固体之后,溶液的质量应该是200.0g+mg-32.4g>167.6g,故 A 错误;
B、由于向滤液中滴加NaCl溶液,产生白色沉淀;说明硝酸银过量,Al 和 Cu完全反应,
假如都是Al,则由
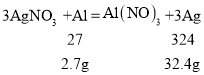
假如都是铜,则由
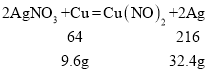
故 2.7g<m<9.6g,故 B 正确;
C、由于反应生成的金属只有Ag,因此在滤渣中加入盐酸不会产生 氢气,故C 错误;
D、由于硝酸银没有完全反应,所以无法求算原AgNO3溶液的溶质质量分数,故 D 错误。
故选B。


科目:初中化学 来源: 题型:
【题目】用化学用语填空
(1)家庭厨房中使用最多的碳酸盐是________;
(2)缺______可能会导致贫血;
(3)构成氯化钠的阴离子结构示意图______;
(4)标出硝酸铵中氮元素化合价______。
(5)治疗胃酸过多的病人可以服用氢氧化铝或者碳酸氢钠,写出这两个的化学方程式______ 、____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】测定水中氢、氧元素的质量比。根据下图进行实验,反应后测得甲中玻璃管(含药品)质量减少a g,乙中U形管(含药品)质量增加b g。
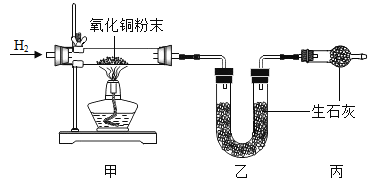
(1)水中氢、氧元素的质量比是__(用含a、b的式子表示)。
(2)下列因素中,对测定结果有影响的是____(填序号)。
A CuO粉末不干燥
B CuO没有完全转化为Cu
C 没有丙装置
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧化钙和过氧化钙(CaO2)的混合物12.8g溶于足量水后,加入足量的Na2CO3溶液,溶液中的Ca2+全部转化为沉淀,过滤、干燥,得到20g CaCO3。则原12.8g混合物中钙元素与氧元素的质量之比为(已知2CaO2+2H2O===2Ca(OH)2+O2↑)( )
A. 5:2 B. 5:3 C. 5:4 D. 1:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】复分解反应存在这样一个规律:较强酸可制取较弱酸。中和反应、盐类的水解也是复分解反应,盐类的水解反应的逆反应是中和反应。盐类的水解反应中,弱酸强碱盐中弱酸根离子对应的弱酸越弱,其盐越容易发生水解。
已知在常温下测得浓度均为0.lmol/L的下列6种溶液的pH:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 8.1 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)请根据上述信息判断下列反应不能发生的是_____(填编号)。
A ![]()
B ![]()
C ![]()
D ![]()
E ![]()
F ![]()
(2)一些复分解反应的发生还遵循其他的规律、下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KC1和NaNO3的混合溶液,首先析出NaCl晶体。
根据上述反应,总结出复分解反应发生的另一规律为_____。
(3)已知溶液的pH与氢离子浓度有直接关系。物质的量浓度均为0.05mol/L的下列五种物质的溶液中,pH由大到小的顺序是_____(填编号)。
①C6H5OH(苯酚) ②CH3COOH ③HClO4 ④HC1O ⑤H2SO4
(4)25℃时,M酸溶液的pH=a,N碱溶液的pH=b。若X为强酸,Y为强碱,且![]() ,若两者等体积混合后,溶液的pH=7.此时溶液中金属阳离子浓度大于酸根阴离子浓度,其原因可能是_____。
,若两者等体积混合后,溶液的pH=7.此时溶液中金属阳离子浓度大于酸根阴离子浓度,其原因可能是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图示中 A~H 为初中化学常见的物质。按单质、氧化物、酸、碱、盐分类,A、B、 C、D、E 是五种不同类别的物质。其中 C 属于单质,F 是配制农药波尔多液的主要成分,反应①和反应②均属于复分解反应,且生成两种颜色不同的沉淀。图中“—”表示两端的物质 间可以发生反应,“→”表示物质间存在着相应的转化关系(部分反应物、生成物以及反应条 件已略去)。请回答:
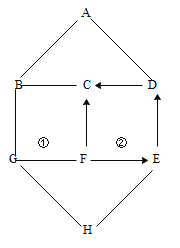
(1)物质 A 的化学式:____________;
(2)反应①的化学方程式____________; 写出一个能实现 D→C 转化的化学方程式____________;
(3)B 和 C 之间反应的现象:____________;
(4)E→D 的基本反应类型是:____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)溶液的溶质可以是固体,也可以是_______或气体;生理盐水是医疗上常用的一种溶液,其溶质为______(填化学式)。
(2)配制溶质的质量分数为5% 的氯化钠溶液。配制步骤:①称量和量取 ②溶解 ③计算 ④装入试剂瓶贴好标签。配制上述溶液的正确顺序是_______(填序号)。
(3)如图为甲、乙两种固体物质的溶解度曲线。
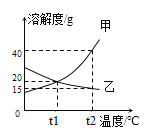
①溶解度随温度升高而增大的物质是_______(填“甲”或“乙”)。
②将t2℃时的甲、乙两种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数甲_______乙(填“<”、“=”或“>”)。
(4)t1℃时,在50 g水中加入18 g乙固体,充分搅拌后得到______(填“饱和”或“不饱和”)溶液,升温至t2℃,此时该溶液中溶质的质量分数为______(计算结果精确到0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某固体混合物含有碳酸钙、氧化钙、铁粉中的一种或几种。取该固体粉末 18.4 g,按下列流程进行实验,其中说法正确的是(不考虑盐酸的挥发)
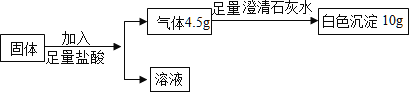
A.生成氢气的质量为 0.2 gB.铁粉的质量为 2.8 g
C.氧化钙的质量为 5.6 gD.溶液中氯化物的质量为 22.2 g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )
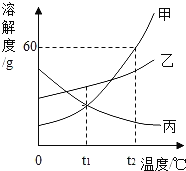
A.t2℃100g甲物质饱和溶液中含有60g甲
B.甲的溶解度大于乙
C.将丙物质饱和溶液变为不饱和溶液,可采用升温的方法
D.t2℃时分别用100g水配制甲、乙的饱和溶液,再降温到t1℃,析出固体的质量甲大于乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com