
如图为NaCl、KNO3的溶解度曲线(水的密度约为1 g/cm3).
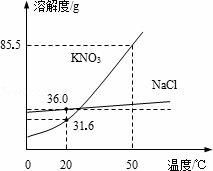
(1)20℃时,KNO3的溶解度是________g,以下实验中:
10 mL水x、y、z中为饱和溶液的是________.
(2)若使NaCl溶液由不饱和变为饱和溶液,一般采用的方法是________或________.
(3)除去KNO3固体中混有的少量NaCl,提纯的步骤是:加水溶解、________、________,然后过滤、洗涤、干燥.
|
分析:(1)根据溶解度的观察方法和饱和溶液的判断方法考虑;(2)根据不饱和溶液变为饱和溶液的方法考虑;(3)根据硝酸钾和氯化钠的溶解度变化情况来分析 解答:解:(1)从20℃向上作垂线与硝酸钾曲线的交点,再向纵坐标作垂线,正好对应31.6 g,所以硝酸钾在该温度下溶解度为31.6 g;因为20℃时硝酸钾在该温度下溶解度为31.6 g,即10 mL水中最多溶解3.16 g;第一次加入2.5 g,没有达到饱和,再加入2.5 g,成了5 g,所以已经饱和了,且没有全部溶解;升温到50℃,溶解度变为85.5 g,即能溶解8.55 g;加入的才5 g,所以升温后不饱和,故饱和溶液只有y; (2)使NaCl溶液由不饱和变为饱和溶液可以是蒸发溶剂,也可以增加溶质; (3)如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂,因为硝酸钾溶解度随温度变化比较大,所以要用冷却热饱和溶液,即先加水溶解,加热制成热的饱和溶液,再进行降温结晶,然后过滤、洗涤、干燥,就可以得到硝酸钾了. 故答案为:(1)31.6;y;(2)蒸发溶剂至饱和;加氯化钠固体至不再溶解;(3)蒸发浓缩;降温结晶. 点评:本题容易出错的地方是对于溶液是否饱和的判断,要根据该温度下该物质的溶解度考虑. |
|
固体溶解度曲线及其作用. |


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:初中化学 来源: 题型:
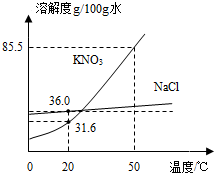
 (2013?香洲区模拟)如图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3).
(2013?香洲区模拟)如图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3).
| ||
| 搅拌(20℃) |
| ||
| 搅拌(20℃) |
| 升温 |
| 至50℃ |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?白云区一模)下表是NaCl和KNO3在不同温度时的溶解度,请根据相关信息回答下列问题.
(2013?白云区一模)下表是NaCl和KNO3在不同温度时的溶解度,请根据相关信息回答下列问题.| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?闵行区二模)如图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3).
(2013?闵行区二模)如图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3).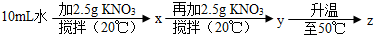
查看答案和解析>>
科目:初中化学 来源: 题型:
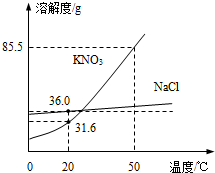 (2012?连云港)如图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3).
(2012?连云港)如图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3).
| ||
| 搅拌(20℃) |
| ||
| 搅拌(20℃) |
| 升温 |
| 至50℃ |
查看答案和解析>>
科目:初中化学 来源: 题型:
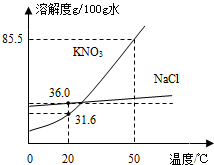 (2013?崇明县二模)如图为NaCl、KNO3的溶解度曲线
(2013?崇明县二模)如图为NaCl、KNO3的溶解度曲线查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com