
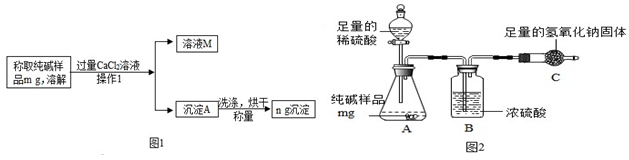
���� ������һ����1�����ݲ�����I��������Ȼ��Ƶ�Ŀ���ǰ�̼���Ƴ�ַ�Ӧ��Ȼ�����˲����ѹ����Һ�������з�����
��2��������Ʒ�е��Ȼ��ƺ��Ȼ��Ʋ���Ӧ�������Ȼ��ƹ��������̼������ȫ��Ӧ�����������Ȼ��ƣ�������ҺM�к��е��������������Ӻ����ӽ��з�����
��3��������CaCl2�������������Na2CO3ʣ�࣬�ټ���CaCl2�������ɳ�����˵���������������������������з�����
��4������������Aû��ϴ�Ӻ�ɣ��ᵼ�¼������̼��������ƫ��������Aϴ�����ɾ�����������Һ�к��������ӣ���ͨ���μ�AgNO3��Һ�۲��Ƿ��г����ķ����жϽ��з�����
��5������̼���ƺ��Ȼ��Ʒ�Ӧ�Ļ�ѧ����ʽ��������ɵ�̼��Ƶ������б������̼��㼴�ɣ�
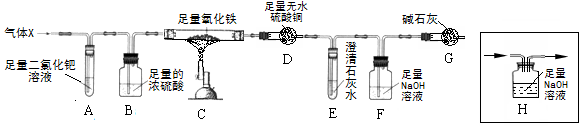
������������1������̼���ƺ�ϡ���ᷴӦ���������ơ�ˮ�Ͷ�����̼���з�����
��2������Ũ�������ˮ�Ժͻ�ѧ����ʽ����д�������з�����
��3�����ݳ���Cװ���ڷ�Ӧǰ���������������ò���������̼���������з�����
��4�����ݡ�����������װ���ڵIJ���������̼û�б����գ������еĶ�����̼��ˮ����Ҳ�����Cװ�ý��з�����
��� �⣺����һ����1��ͨ������I�õ��˹����Һ�壬���Բ�����������ǹ��ˣ�
��2����Ʒ�е��Ȼ��ƺ��Ȼ��Ʋ���Ӧ�������Ȼ��ƹ��������̼������ȫ��Ӧ�����������Ȼ��ƣ�������ҺM�к��е��������������Ӻ����ӣ�
��3�����Ȼ�����ʣ�࣬����̼������Һ������̼��ư�ɫ���������Ȼ���û��ʣ�࣬����̼������Һ�����Ա仯����ѡ��B��
��4��������Aû��ϴ�Ӻ�ɣ��ᵼ�¼������̼��������ƫ��̼���Ƶ�����������ƫ���жϳ���Aϴ���ķ����ǣ�ȡ���һ��ϴ��������Һ���μ�AgNO3��Һ�����ް�ɫ��������ϴ�Ӹɾ���
��5������Ʒ��̼���Ƶ�����Ϊx����
Na2CO3+CaCl2=2NaCl+CaCO3��
106 100
x 10g
$\frac{106}{x}$=$\frac{100}{10g}$
x=10.6g
��Ʒ��Na2CO3��������Ϊ��$\frac{10.6g}{12g}$��100%��88.3%��
����������1��̼���ƺ�ϡ���ᷴӦ���������ơ�ˮ�Ͷ�����̼����ѧ����ʽΪ��Na2CO3+H2SO4=Na2SO4+H2O+CO2����
��2��Ũ���������ˮ�ԣ����Bװ�õ������dz�ȥˮ������������̼���������Ʒ�Ӧ����̼���ƺ�ˮ����ѧ����ʽΪ��CO2+2NaOH=Na2CO3+H2O��
��3��Cװ���ڷ�Ӧǰ�����������Dz���������̼��������
��4��������������װ���ڵIJ���������̼û�б����գ������еĶ�����̼��ˮ����Ҳ�����Cװ�ã�
�ʴ�Ϊ������һ����1�����ˣ�
��2�������Ӻ����ӣ�
��3��B��
��4��ƫ���ޣ�
��5��88.3%��
����������1��Na2CO3+H2SO4=Na2SO4+H2O+CO2����
��2����ȥˮ������CO2+2NaOH=Na2CO3+H2O��
��3��C��
��4��װ���ڵIJ���������̼û�б����գ������еĶ�����̼��ˮ����Ҳ�����Cװ�ã�
���� �����Ѷ�̫�����˶��Ļ�ѧ֪ʶ��Ҫ�����Դ������֪ʶȫ�棬�ټ����㹻��ϸ�ĺ����IJ��У�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ӵ����еġ��⡱ͨ����ָ��Ԫ�� | |
| B�� | ���ʺͻ��������ڰ�����ϵ | |
| C�� | ��������ͬ�����Ӳ�һ����ͬ��Ԫ�ص�ԭ�� | |
| D�� | �ֽⷴӦ�ķ�Ӧ��һ�����ǵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �٢� | C�� | �ڢ� | D�� | �ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ƻ�� | B�� | ���� | C�� | ���� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������� | B�� | ������̼ | C�� | ���� | D�� | ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com