某炼炉厂日产生铁(含杂质的质量分数为4%)2240t,计算需含Fe2O3质量分数为80%的赤铁矿质量.
【答案】
分析:利用变化前后铁元素质量相等解决,计算时先要把不纯的物质转化为纯净物计算,一般是物质的质量乘以这种物质中纯净物的质量分数就使混合物转化成了纯净物的质量.
解答:解:生铁中铁的质量是:m(Fe)=2240t×(1-4%)=2150.4t
Fe
2O
3中铁的质量分数为:
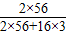
=0.7;
需要的Fe
2O
3的质量=
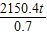
=3072t
则需要需含Fe
2O
3质量分数为80%的赤铁矿质量是:3072t÷80%=3840t
答:需含Fe
2O
3质量分数为80%的赤铁矿质量是3840t.
点评:此题是对含杂质物质的有关化学计算,问题的关键是首先解决纯净物与混合物的相互转化,混合物的质量乘以某种物质的质量分数即为这种纯净物质的质量,再利用化学式是解决这类题目的关键.

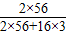 =0.7;
=0.7;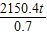 =3072t
=3072t

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案